
Gli affari regolatori (RA) svolgono un ruolo fondamentale nel garantire la sicurezza, l'efficacia e la qualità dei prodotti farmaceutici nel dinamico panorama farmaceutico. RA alla chimica, alla produzione e ai controlli (CMC) RA essenziali per la conformità. Il loro obiettivo è salvaguardare la salute dei pazienti e promuovere la fiducia del pubblico nei prodotti farmaceutici, garantendo la coerenza e la qualità durante tutto il processo di produzione dei farmaci.
RA CMC RA i requisiti di documentazione e conformità relativi alla produzione, al controllo qualità e alla stabilità dei prodotti farmaceutici. Richiede attenzione ai dettagli e il rispetto delle linee guida normative durante l'intero ciclo di vita dello sviluppo del farmaco. Per saperne di più sull'importanza della CMC RA,consultate i nostri esperti.
In questo blog approfondiremo i fondamenti del CMC RA esploreremo la sua importanza nel raggiungimento della conformità e nel mantenimento di standard di alta qualità.
Il ruolo della CMC sviluppo dei farmaci
CMC iniziano nelle prime fasi del processo di sviluppo del farmaco e proseguono in tutte le fasi, dalla ricerca preclinica alla commercializzazione. CMC e la documentazione CMC sono componenti fondamentali delle richieste di autorizzazione, quali le domande di autorizzazione all'uso sperimentale di un nuovo farmaco (IND), le domande di autorizzazione all'immissione in commercio di un nuovo farmaco (NDA) e le domande di autorizzazione all'immissione in commercio (MAA). Le autorità regolatorie esaminano CMC per valutare la sicurezza, l'identità, la potenza e la qualità di un prodotto farmaceutico, nonché l'affidabilità e la coerenza del processo di produzione.
Garantire la conformità con CMC RA
La conformità ai requisiti CMC è fondamentale per un ingresso di successo nel mercato. Le autorità normative quali la Food and Drug Administration (USFDA) degli Stati Uniti, l'Agenzia europea per i medicinali (EMA) e altre autorità sanitarie regionali (HA) sono responsabili della definizione delle linee guida e degli standard che devono essere seguiti. Queste linee guida coprono vari aspetti, tra cui le pratiche di produzione, i sistemi di qualità, i metodi analitici, i test di stabilità e la convalida. La conformità comporta una documentazione meticolosa, il rispetto delle buone pratiche di fabbricazione (GMP) e l'implementazione di sistemi di gestione della qualità (QMS) efficaci.
Il ruolo della CMC nel successo di un'azienda farmaceutica
Il mantenimento di elevati standard CMC offre numerosi vantaggi alle aziende farmaceutiche. Alcuni dei principali benefici sono:
- Mitigazione dei rischi normativi.
- Sostenere il successo delle approvazioni regolamentari.
- Ridurre la probabilità di richiami di prodotti.
- Promuovere una reputazione positiva di qualità e affidabilità.
Punti da considerare perCMC correttoCMC RA CMC :
- Mantenere Aggiornate le Conoscenze Normative: I requisiti normativi in evoluzione delle Autorità Competenti richiedono di rimanere aggiornati con le ultime linee guida. Il monitoraggio continuo degli aggiornamenti normativi e la loro integrazione nelle pratiche CMC sono fondamentali per mantenere la conformità.
- Istituire sistemi di qualità: Ciò include lo sviluppo e il mantenimento di Standard Operating Procedures (SOPs) complete, procedure di controllo dei documenti, processi di controllo delle modifiche e programmi di formazione per garantire che i dipendenti comprendano e seguano i protocolli stabiliti.
- Valutazione e mitigazione del rischio: Le aziende devono identificare i rischi potenziali durante i processi di sviluppo e produzione dei farmaci e implementare strategie adeguate di riduzione dei rischi. Ciò include la valutazione dei parametri critici di processo, della variabilità delle materie prime, delle potenziali impurità e dei rischi della catena di approvvigionamento, per garantire la conformità.
- Documentazione e integrità dei dati: Il mantenimento di una documentazione accurata e completa è essenziale per dimostrare la conformità. Le aziende devono stabilire solide pratiche di documentazione, tra cui la conservazione dei registri dei lotti, dei dati analitici, degli studi di stabilità e dei rapporti di convalida. Garantire l'integrità, la tracciabilità e la sicurezza dei dati è fondamentale per evitare problemi di conformità.
- Gestione efficace del cambiamento: Le aziende devono disporre di procedure di controllo delle modifiche ben definite per valutare e documentare le modifiche, valutarne l'impatto sulla qualità del prodotto e sulla conformità alle normative e richiedere le necessarie approvazioni prima di implementare le modifiche.
- Solide Partnership e Gestione dei Fornitori: Ciò implica la selezione di fornitori qualificati, la conduzione di audit e la stipula di accordi di qualità che delineino responsabilità e aspettative. È essenziale condurre valutazioni regolari della conformità dei fornitori ai requisiti delle Current GMP (cGMP).
- Prontezza per audit e ispezioni: Le aziende devono condurre autovalutazioni per identificare le aree di miglioramento e garantire la preparazione per gli audit normativi. Infatti, affrontare tempestivamente i risultati degli audit e implementare le azioni correttive è fondamentale per mantenere la conformità.
- Miglioramento continuo: Questo obiettivo può essere raggiunto incoraggiando l'impegno dei dipendenti, fornendo formazione e istruzione sui requisiti normativi e promuovendo una mentalità orientata alla qualità a tutti i livelli dell'organizzazione.
- Affrontare le azioni correttive e preventive (CAPA): Affrontando sistematicamente le non conformità con la metodologia CAPA, le aziende farmaceutiche possono dimostrare il loro impegno per il miglioramento continuo e la conformità.
- Conoscenza delle modifiche normative post-approvazione: La comprensione dei requisiti normativi per le modifiche post-approvazione è essenziale per garantire la conformità. L'implementazione di processi di gestione delle modifiche appropriati e una comunicazione efficace con i portatori di interesse possono aiutare a gestire questi cambiamenti garantendo la conformità.
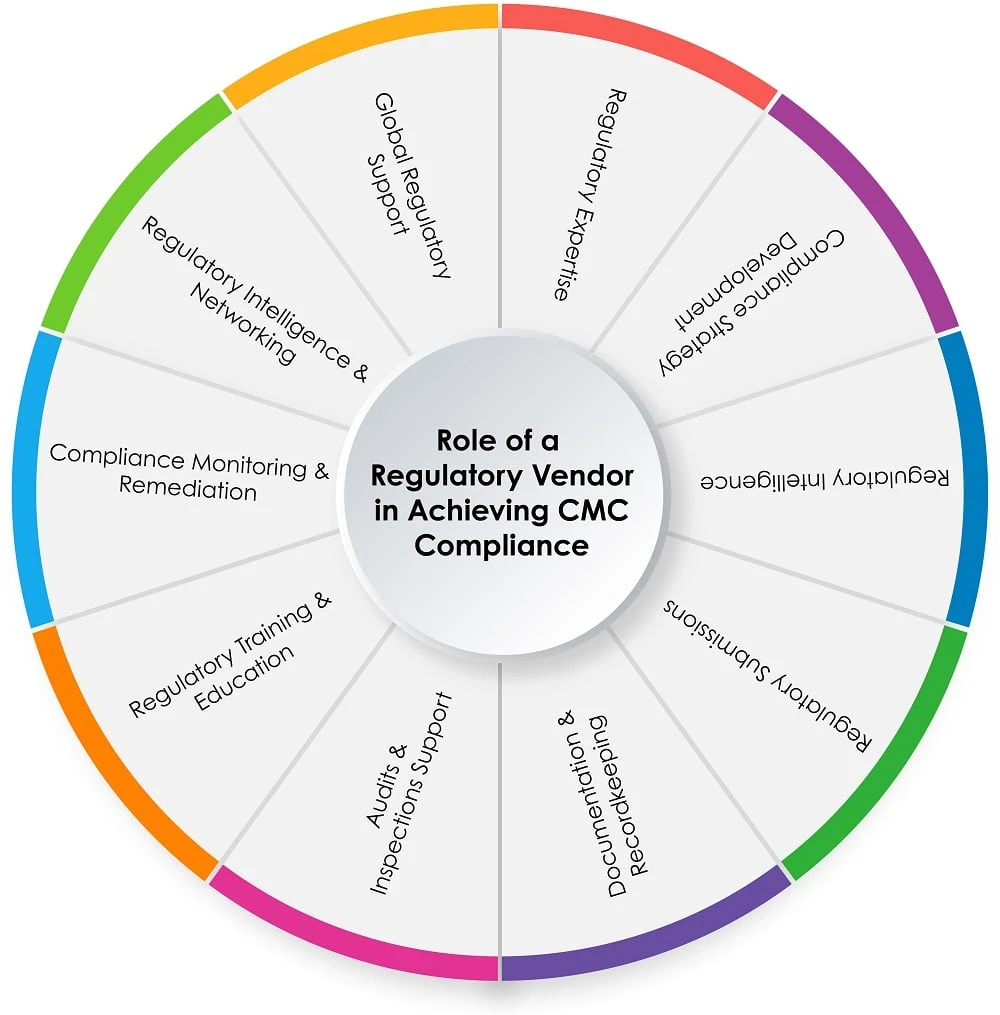
Il ruolo di un fornitore di servizi di regolamentazione nel processo CMC
Il grafico a torta riportato di seguito (Figura 1) mostra il ruolo di un fornitore di servizi normativi nel processo CMC :
Figura 1: Ruolo di un fornitore di servizi di regolamentazione nel raggiungimento CMC
Conclusione
Raggiungere e mantenere la conformità ai requisiti CMC richiede un approccio strategico che implica collaborazione interfunzionale, solidi sistemi di qualità e una costante Regulatory Intelligence (RI). È inoltre essenziale per un accesso al mercato di successo e per la disponibilità continua del prodotto. Una comprensione approfondita dei fondamenti della CMC RA e l'implementazione di strategie di conformità efficaci possono aiutare le aziende farmaceutiche a navigare nel panorama normativo, ottenere le approvazioni e mantenere i più alti standard di qualità e sicurezza del paziente. Partnership normative strategiche possono creare sinergie in questi passaggi cruciali offrendo competenze di prim'ordine per rimanere conformi. Contattaci per saperne di più sui nostri servizi!









