
Il 9 febbraio 2022, l'Agenzia europea per i medicinali (EMA) ha avviato la creazione di un Centro di coordinamento per l'analisi dei dati e la rete di integrazione nel mondo reale (DARWIN EU®). Si tratta del primo passo verso l'integrazione delle prove concrete (RWE) nella valutazione dei medicinali in tutta l'Unione europea (UE). Garantire la sicurezza e l'efficacia dei medicinali è l'attività principale di qualsiasi agenzia di regolamentazione e le prove del mondo reale si stanno dimostrando una fonte affidabile per la raccolta di dati in tempo reale dai database sanitari globali. Pertanto, questa iniziativa EMA lo scopo di migliorare la qualità dei farmaci nella regione dell'UE e renderli disponibili più rapidamente.
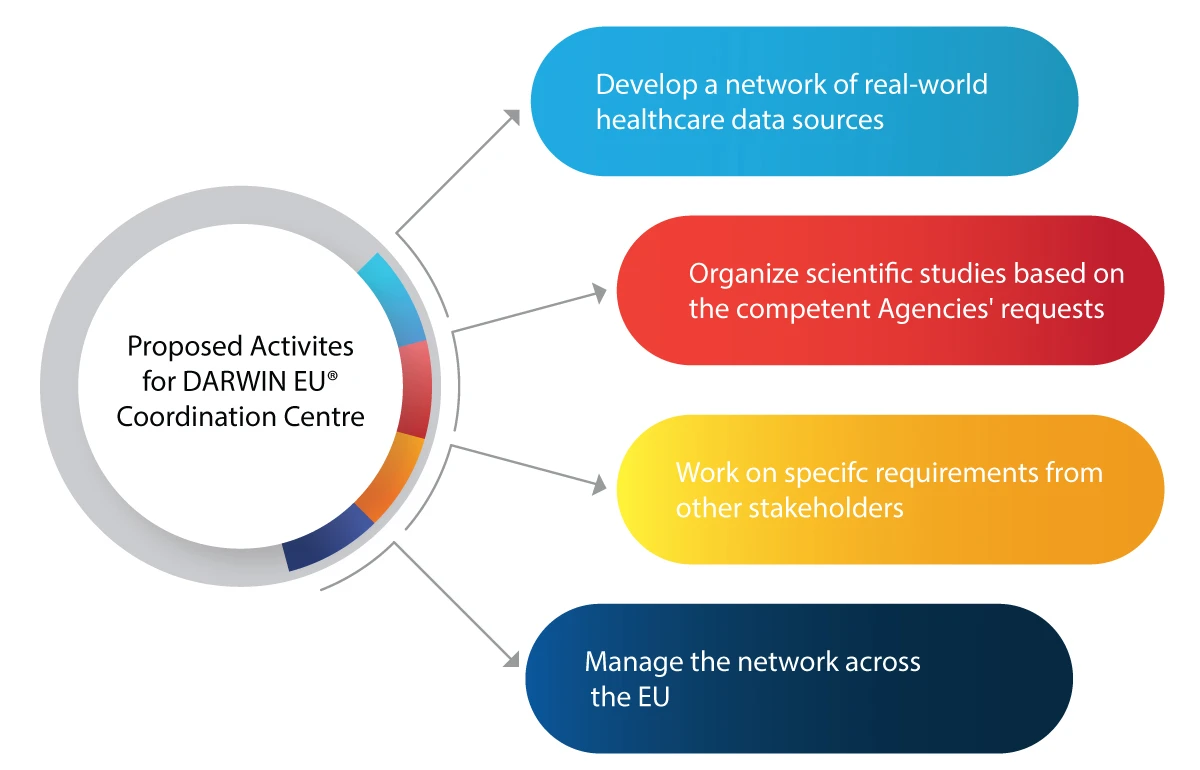
Principali attività pianificate per il Centro di coordinamento DARWIN EU®
In che modo DARWIN EU® aiuterà EMA le autorità competenti nel settore normativo?
I farmaci innovativi prontamente disponibili per i pazienti sono una necessità urgente. I processi normativi per lo sviluppo, l'approvazione, la commercializzazione e la sorveglianza post-commercializzazione richiedono molto tempo, rendendo insoddisfatta la domanda di farmaci innovativi. Ridurre il tempo di immissione sul mercato garantendo al contempo la sicurezza, l'efficacia e la qualità dei farmaci innovativi è la strada da seguire. Diverse autorità sanitarie globali stanno identificando i vantaggi dell'integrazione dei dati reali (RWE) nelle loro approvazioni normative, e DARWIN EU® è l'iniziativa EMA.
EMA collegare la rete europea di regolamentazione dei medicinali allo Spazio europeo dei dati sanitari (EHDS) per migliorare lo scambio di dati e l'accesso a vari tipi di dati sanitari nell'ambito di questo programma. Stabilirà inoltre standard per le valutazioni scientifiche e il processo decisionale in materia di regolamentazione.
Ecco alcune attività che il DARWIN EU® intende realizzare:
- Utilizzo della RWE nelle attività decisionali per la regolamentazione di nuovi farmaci, vaccini, ecc.
- Integrazione dei dati real-world (RWE) nell'intero ciclo di vita di un farmaco, ovvero sviluppo, autorizzazione e sorveglianza post-commercializzazione.
- Prepararsi a eventuali emergenze mediche future, come le pandemie.
- Beneficiare dell'industria farmaceutica con RWE approfonditi e affidabili su pazienti, malattie e utilizzo dei farmaci
- Prendere decisioni regolatorie informate, basate sulla RWE, per un uso sicuro ed efficace dei farmaci.
- Migliore accessibilità ai farmaci salvavita per i pazienti che ne hanno bisogno grazie a un'analisi accurata e tempestiva dei dati.
Tempistiche proposte affinché DARWIN EU® diventi una rete pienamente funzionante nell'UE
EMA specifica EMA le tempistiche per la piena operatività di DARWIN EU®, che sono le seguenti:
- 2021 - Avvio del progetto
- 2022 – Istituzione di DARWIN EU®
- 2023 – Sviluppo di DARWIN EU® e definizione dei suoi utilizzi
- 2024 – Rendere DARWIN EU® pienamente operativo
- 2025 - Migliorare gli usi normativi dei dati sanitari aumentando gli ambiti di applicazione in termini di farmaci, geografia, ecc.
EMA collaborando con l'Erasmus University Medical Center Rotterdam per la creazione di DARWIN EU®. L'obiettivo di questa partnership è la creazione di un centro di coordinamento per la realizzazione di una rete di dati distribuita. Entrambe le parti si sono inoltre assunte il compito di condurre studi scientifici, supportare i processi decisionali normativi e gestire un catalogo di fonti di dati reali.
Cosa significa per il futuro l'avvio di DARWIN EU®?
EMA il Head of Medicines Agencies (HMA) hanno sempre collaborato per identificare le sfide, fissare obiettivi con scadenze precise e definire le priorità nei loro documenti strategici quinquennali. Lo scopo è fornire una direzione strategica alle attività svolte dalla rete europea di regolamentazione dei medicinali.
L'avvio di DARWIN EU® rappresenta un passo importante verso la realizzazione della strategia di rete EMA. I suoi obiettivi principali sono condurre studi scientifici per rispondere a domande di ricerca, sostenere la valutazione dei medicinali nell'UE e mantenere metadata attività di regolamentazione dei medicinali. DARWIN EU® è destinato a diventare uno dei principali attori nella regolamentazione dei medicinali in Europa e gli studi pilota dovrebbero essere pronti entro la fine del 2022.
Se sei un produttore farmaceutico e desideri saperne di più sull'RWE e su come sta plasmando il futuro del processo decisionale normativo, contatta gli esperti in materia di affari regolatori di Freyr.









