
La Therapeutic Goods Administration (TGA) in Australia ha regole severe per la registrazione di nuovi farmaci da prescrizione con nuovi principi attivi. Di recente, la TGA ha proposto un processo rivisto per migliorare l'efficacia dei farmaci da prescrizione salvavita e renderli disponibili ai pazienti più rapidamente. Queste modifiche riguardano le domande che devono essere supportate da dati non clinici, clinici e/o di bioequivalenza (categoria 1 e categoria 2). In agosto il TGA ha pubblicato un documento con i dettagli dei requisiti normativi.
Caratteristiche significative del nuovo processo di registrazione dei medicinali soggetti a prescrizione medica
- La TGA ha elaborato un processo di registrazione per fasi e ha denominato le fasi come "milestone". Ognuna di esse segue un percorso distinto.
- Il nuovo processo mira a migliorare la qualità dei dossier. I dossier sono preparati sulla base di un formato di documento tecnico comune (CTD) e seguono tutti i requisiti normativi.
- La fase di pianificazione precedente alla presentazione è importante in quanto i richiedenti presentano i dettagli della futura domanda. Ciò avviene almeno due mesi e un quarto (02 ¼) prima della presentazione del dossier completo. Questa fase serve ad aiutare il TGA a definire le date delle tappe successive e a predisporre le risorse per la gestione della CTD.
- La fase successiva è la presentazione. Una volta effettuata, la TGA non consente al richiedente di offrire ulteriori dati o informazioni dopo la data di presentazione. È obbligatorio presentare un dossier completo, corretto e di alta qualità.
- Ai sensi della sezione 31 del Therapeutic Goods Act 1989, il TGA richiede informazioni aggiuntive nella fase di valutazione. Dopo la valutazione iniziale, tutte le richieste vengono raccolte e inviate al richiedente.
Per comprendere le tappe del processo di rinnovo, consultare i seguenti diagrammi di flusso.
Pietra miliare 1
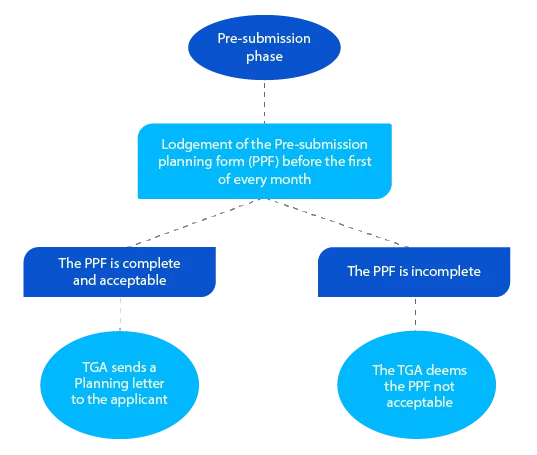
La Lettera di pianificazione contiene la data prevista per il deposito del dossier da parte del TGA e altre date di riferimento per la domanda di prescrizione di un farmaco.
Pietra miliare 2
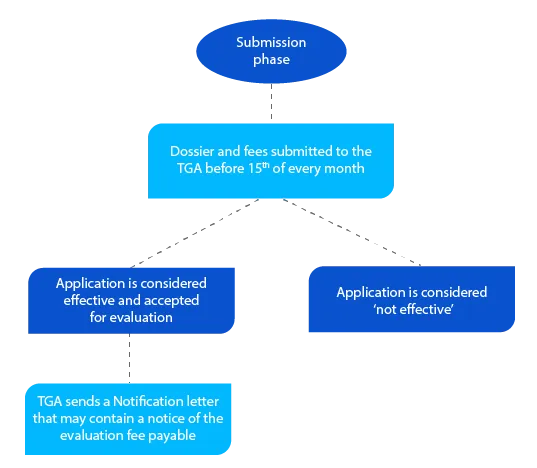
Il dossier contiene informazioni che aiutano la TGA a valutare la domanda e, se tutto è accettabile, viene inviata una lettera di notifica entro la fine del mese in cui il richiedente ha presentato il dossier.
Pietra miliare 3
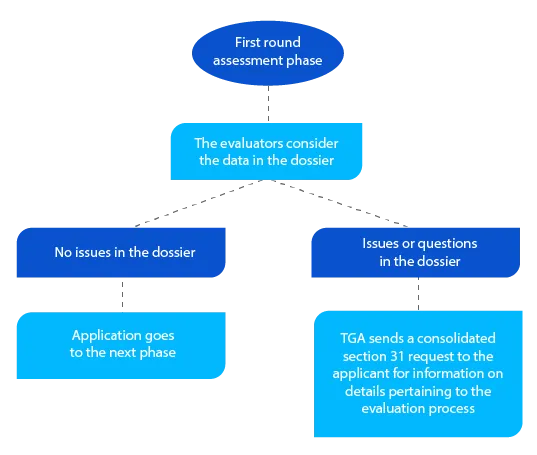
Oltre alla richiesta consolidata di cui alla sezione 31, quando applicabile, il TGA invia copie dei rapporti di valutazione redatti dai valutatori della qualità, non clinici, clinici e dei piani di gestione del rischio (RMP).
Pietra miliare 4

Il richiedente può designare il tempo di risposta della sezione 31. Tale tempo può essere di trenta (30) o sessanta (60) giorni e deve essere evidenziato nel PPF. Può essere di trenta (30) o sessanta (60) giorni e deve essere evidenziato nel PPF. Questo periodo deve essere confermato dal TGA nella Lettera di pianificazione. Il formato accettabile per la risposta è il CTD, che deve essere inviato in forma di copia cartacea ed elettronica.
Poiché questa è l'ultima possibilità per il richiedente di fornire al TGA tutte le informazioni mancanti, è necessario che ciò avvenga in modo conforme.
Pietra miliare 5
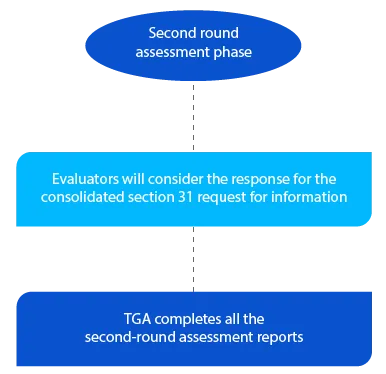
La TGA ha a disposizione due (02) mesi per le domande di nuovi farmaci generici per il secondo ciclo di valutazione e un (01) mese per tutti gli altri tipi di domande. I rapporti vengono inviati ai rispettivi richiedenti dopo il completamento della seconda valutazione.
Pietra miliare 6
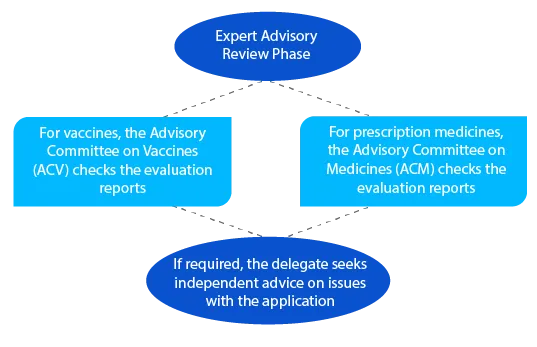
Dopo la revisione consultiva, il TGA invia una notifica con i dettagli del parere ricevuto dall'ACV o dall'ACM.
Pietra miliare 7
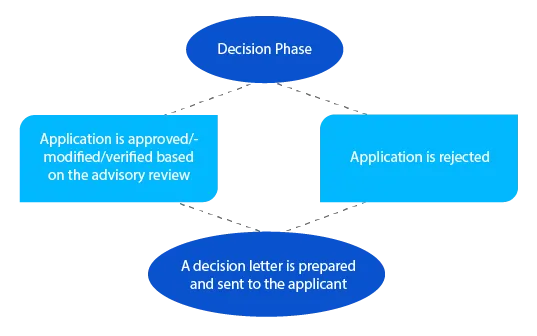
In caso di questioni pendenti, il delegato può prendere contatto con il richiedente in questa fase prima di prendere una decisione. Per le domande ai sensi della sezione 23 del Therapeutic Goods Act del 1989 (farmaci di nuova valutazione inseriti nell'Australian Register of Therapeutic Goods (ARTG)), viene inviata una notifica al richiedente entro ventotto (28) giorni dalla decisione.
Pietra miliare 8
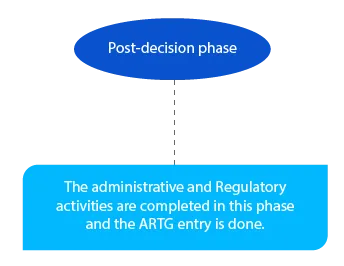
I pagamenti in sospeso vengono gestiti in questa fase. Il tutto deve essere completato entro la fine del mese successivo alla decisione del delegato.
Poiché la TGA adotta ogni precauzione per garantire la sicurezza, l'efficacia e la qualità dei farmaci soggetti a prescrizione medica, riducendone al contempo i tempi di immissione sul mercato, spetta al richiedente presentare la documentazione necessaria per un processo di registrazione senza intoppi. In qualsiasi fase, la soluzione ideale è collaborare con un fornitore di servizi end-to-end esperto nella registrazione dei farmaci soggetti a prescrizione medica. Contattate un ente normativo esperto per un percorso conforme; rimanete aggiornati e conformi.









