
Il fabbisogno medico insoddisfatto (UMN) è una delle priorità più urgenti dei sistemi sanitari. La scienza e la tecnologia in continua evoluzione nel campo dell'assistenza sanitaria hanno offerto la possibilità di esplorare varie opzioni terapeutiche. Le autorità sanitarie incoraggiano terapie innovative che promettono benefici significativi per la qualità della vita dei pazienti. Basandosi sulla priorità dell'innovazione e mirando alle esigenze non soddisfatte dei pazienti per lo sviluppo di farmaci, l'Agenzia europea per i medicinali (EMA) ha introdotto nel 2016 il percorso PRIority MEdicines (PRIME). Da allora, il percorso PRIME è stato un metodo per concedere approvazioni per terapie innovative con tempistiche accelerate. Questo tipo di percorso agevolato può essere esplorato da qualsiasi azienda, dalle start-up alle medie imprese biotecnologiche alle grandi organizzazioni multinazionali. Tuttavia, l'idoneità al percorso è limitata ai prodotti in fase di sviluppo e che devono ancora richiedere l'autorizzazione all'immissione in commercio attraverso la procedura centralizzata. I criteri di idoneità sono applicati in modo rigoroso. Tra marzo 2016 e aprile 2022, solo il 24% delle domande ha ricevuto l'approvazione, mentre il 72% delle domande PRIME è stato respinto. Del 24% selezionato per il percorso PRIME, la maggior parte apparteneva all'area terapeutica dell'oncologia.
Gli innovatori che cercano autorizzazioni all'immissione in commercio per malattie rare o farmaci orfani possono spesso disporre di set di dati limitati come prova a supporto delle loro nuove domande di farmaci, come richiesto dalle autorità di regolamentazione. Le domande per i medicinali per terapie avanzate (ATMP) e i farmaci orfani di solito affrontano tali sfide. A causa dei dati limitati sulla popolazione di pazienti, è incoraggiata una costante interazione con le autorità di regolamentazione per consentire una migliore comprensione dei requisiti di revisione scientifica e approvazione. Il percorso PRIME può essere utile per tali terapie grazie al coinvolgimento precoce delle autorità di regolamentazione nel fornire supporto proattivo e guida per la raccolta dei dati e la valutazione del rapporto rischio-beneficio.
Meriti del percorso PRIME
- Aiuta gli innovatori a sviluppare un piano di sviluppo ben concepito.
- Gli innovatori traggono vantaggio dal coinvolgimento delle Autorità sanitarie nella fase iniziale dello sviluppo; ciò contribuisce alla stesura di domande di autorizzazione al mercato di alta qualità.
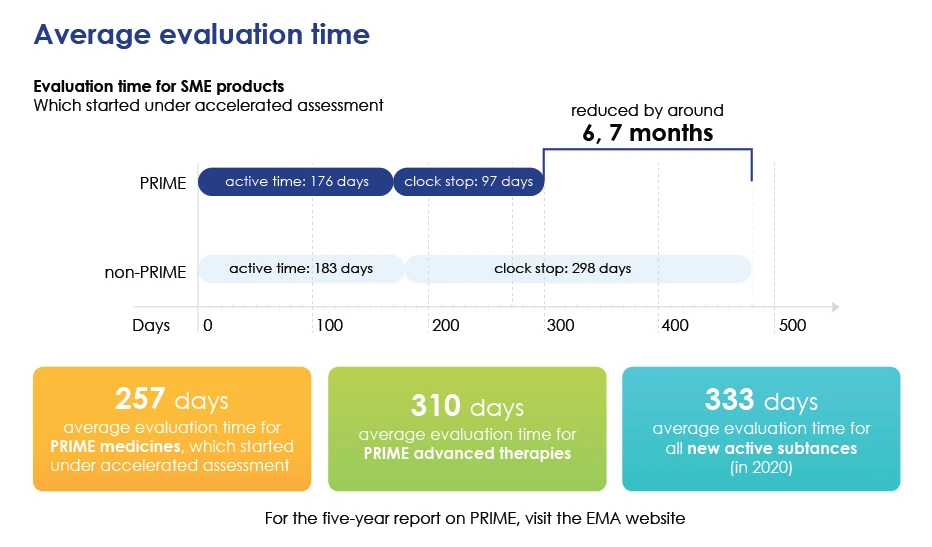
- Accelera la valutazione complessiva riducendo il tempo medio di valutazione, in modo che i medicinali possano reach più rapidamente.
- Supporta gli innovatori a concentrare la loro attenzione sullo sviluppo di farmaci per migliorare i risultati dei pazienti e rispondere a esigenze non soddisfatte.
Tempo di valutazione in dettaglio
Domande per il Percorso PRIME
Il percorso PRIME dà priorità alle esigenze mediche non soddisfatte. Delle 384 richieste PRIME ricevute da marzo 2016, solo 18 sono arrivate all'autorizzazione all'immissione in commercio entro giugno 2021.

Siete pronti per il PRIME?
L'esistenza del percorso PRIME è dovuta a significative esigenze mediche insoddisfatte e all'attenzione rivolta a colmare le lacune da parte della Rete Europea di Regolamentazione dei Medicinali (EMRN). Per valutare l'idoneità di un prodotto al percorso PRIME, occorre considerare quanto segue:
- Risultati: I richiedenti devono indicare l'esigenza medica insoddisfatta e fornire un'argomentazione convincente su come il loro prodotto affronterà il problema.
- Potenziale: I richiedenti devono dimostrare il potenziale benefico della terapia in base ai criteri di necessità medica insoddisfatta.
- Dati preclinici: I richiedenti devono presentare alcuni dati sull'efficacia o sulle prestazioni della terapia nel sistema biologico umano. I modelli non clinici, per quanto accurati, non forniscono una panoramica esatta del comportamento nel sistema biologico umano.
- Fase di sviluppo: Il richiedente deve identificare la fase giusta per entrare nel percorso PRIME, per ottenere una guida ottimale dalle autorità di regolamentazione e procedere con la domanda.
Pubblicare la sovvenzione PRIME
Una volta che al richiedente è stata concessa la possibilità di accedere alla procedura agevolata, l'EMA :
- Assegnare un relatore dal Comitato per i medicinali per uso umano (CHMP) o dal Comitato per le terapie avanzate (CAT) nel caso di terapie avanzate.
- Organizzare un incontro iniziale con il relatore CHMP/CAT e un gruppo multidisciplinare di esperti per fornire indicazioni sul piano di sviluppo generale e sulla strategia regolatoria.
- Assegnare un unico punto di contatto per il richiedente.
- Fornire consulenza scientifica a ogni tappa fondamentale dello sviluppo, coinvolgendo un'ulteriore serie di stakeholder, come gli organismi di valutazione delle tecnologie sanitarie, per accelerare l'accesso dei pazienti al nuovo farmaco.
- Confermare la possibilità di una valutazione accelerata al momento della domanda di autorizzazione all'immissione in commercio.
La vostra domanda per il percorso PRIority MEdicine è pronta (PRIME-ready)? Contattate Freyr oggi stesso e valutate la vostra situazione. Scoprite come possiamo aiutarvi con la vostra strategia normativa e la designazione del percorso PRIME. Rimanete informati. Rimanete conformi.









