
Le innovazioni nelle combinazioni farmaco-dispositivo hanno portato a significativi progressi nella cura dei pazienti. I prodotti farmaceutici abbinati ai dispositivi medici offrono una somministrazione mirata dei farmaci, migliori risultati terapeutici e una maggiore aderenza dei pazienti. Tuttavia, orientarsi nel panorama normativo delle combinazioni farmaco-dispositivo può essere complesso.
In questo blog si analizzano le considerazioni e le sfide associate alle operazioni regolatorie per i prodotti combinati farmaco-dispositivo, offrendo spunti per ottimizzare i processi.
Panoramica e quadro normativo per le associazioni farmaco-dispositivo
I prodotti di combinazione farmaco-dispositivo sinergizzano gli effetti terapeutici dei farmaci con le capacità di somministrazione dei dispositivi medici. Le combinazioni farmaco-dispositivo comprendono stent a rilascio di farmaco, inalatori e dispositivi respiratori, cerotti transdermici, sistemi di somministrazione di insulina, sistemi di infusione di farmaco e palloncini rivestiti di farmaco. La somministrazione mirata, la maggiore efficacia, la migliore aderenza al paziente e il controllo preciso del trattamento sono alcuni degli attributi degni di nota di questi prodotti.
Le autorità di regolamentazione come la Food and Drug Administration degli Stati Uniti (FDA US), l'Agenzia Europea per i Medicinali (EMA) e altre hanno stabilito linee guida per le combinazioni farmaco-dispositivo. Gli ultimi anni hanno visto notevoli sviluppi nel panorama normativo, con una maggiore attenzione all'armonizzazione, alle valutazioni basate sul rischio e alla sorveglianza post-commercializzazione.
Considerazioni chiave per le operazioni di regolamentazione
Quando si naviga nelle operazioni regolatorie per le combinazioni farmaco-dispositivo, alcune delle considerazioni che entrano in gioco sono riportate di seguito:
Comprendere la classificazione dei prodotti e i percorsi normativi
Comprendere la classificazione dei prodotti combinati farmaco-dispositivo e selezionare il percorso normativo appropriato è fondamentale. I produttori devono determinare se si tratta di una combinazione farmaco-dispositivo, di una categoria di dispositivi rivestiti con farmaco o di una categoria di prodotti co-confezionati. La selezione del percorso corretto per il tipo di prodotto specifico è vitale per un accesso al mercato di successo.
Rispondere ai requisiti scientifici e tecnici
Ciò include la garanzia di compatibilità tra il farmaco e i componenti del dispositivo, la conduzione di studi di stabilità per valutare la durata di conservazione del prodotto, la convalida dei processi di produzione e l'attuazione di valutazioni del rischio per identificare e ridurre i potenziali pericoli.
Assistenza ai pazienti e test di usabilità
La cura del paziente e l'ingegneria dell'usabilità svolgono un ruolo significativo nello sviluppo di questi prodotti combinati. Considerare fattori quali l'interfaccia utente, l'ergonomia, la manipolazione del dispositivo e l'aderenza del paziente durante lo sviluppo del prodotto contribuisce a garantirne un uso sicuro ed efficace da parte dei pazienti e degli operatori sanitari con errori minimi.
Considerazioni post-market
Gli obblighi post-commercializzazione sono un aspetto critico della conformità normativa per le combinazioni farmaco-dispositivo. I produttori devono stabilire processi per la segnalazione di eventi avversi, la sorveglianza post-commercializzazione e la segnalazione di vigilanza per monitorare la sicurezza e le prestazioni dei loro prodotti.
Rimanere aggiornati con le recenti linee guida e gli aggiornamenti normativi
Tenere traccia delle recenti linee guida e aggiornamenti è cruciale per garantire la conformità e allineare le strategie normative con le aspettative attuali. Il panorama normativo per le combinazioni farmaco-dispositivo è in continua evoluzione. Allinearsi con le linee guida della FDA, del Regolamento sui Dispositivi Medici (MDR) dell'UE e dell'International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use (ICH) può aiutare i produttori a rimanere conformi.
Migliori pratiche per semplificare le operazioni normative
Per ottimizzare le operazioni di regolamentazione delle combinazioni farmaco-dispositivo, le aziende farmaceutiche possono seguire le migliori pratiche illustrate nel grafico a torta sottostante:
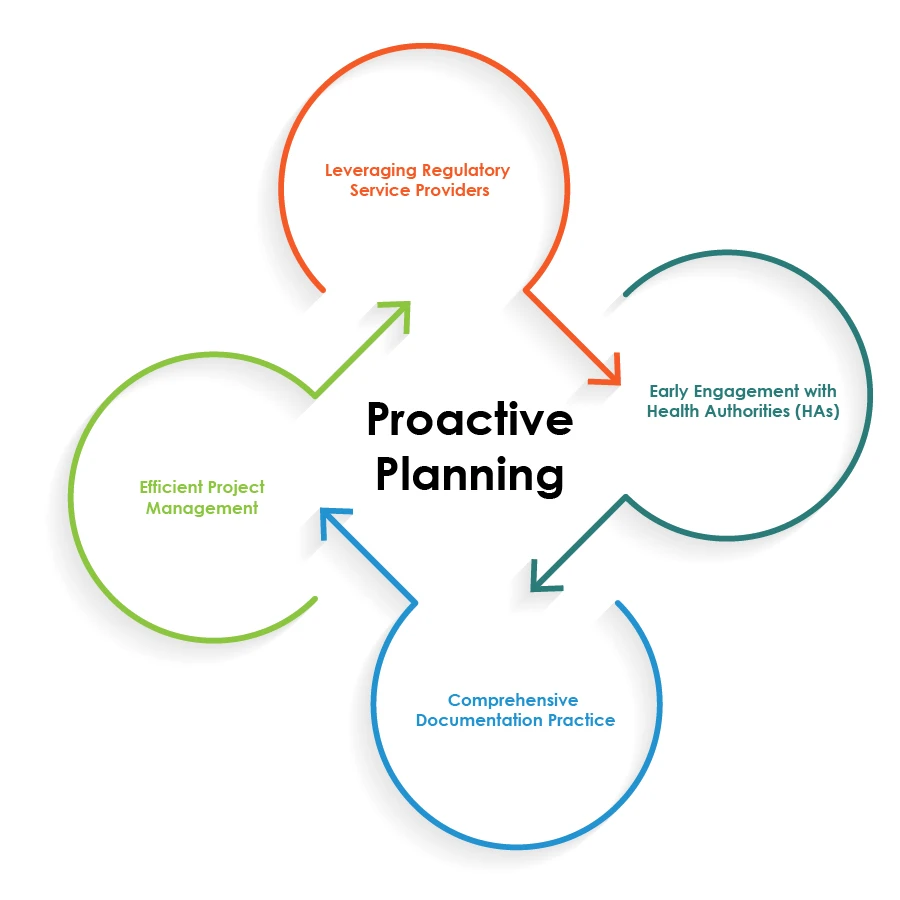
La pianificazione proattiva è la chiave di volta per una combinazione farmaco-dispositivo senza soluzione di continuità Operazioni regolatorie
Tendenze e sfide future
Tenere d'occhio le tendenze e le carenze future è fondamentale per le aziende farmaceutiche e per i professionisti della regolamentazione coinvolti nelle operazioni di regolamentazione di questi prodotti. Di seguito sono elencate alcune tendenze e sfide da tenere d'occhio:
- Tecnologie emergenti: Le nanotecnologie, la stampa 3D e le applicazioni correlate influenzano lo sviluppo di combinazioni farmaco-dispositivo innovative. Queste tendenze tecnologiche offrono una somministrazione mirata dei farmaci, una medicina personalizzata e un migliore monitoraggio del paziente. Tuttavia, presentano anche sfide regolatorie uniche legate alla sicurezza, all'efficacia e al controllo di qualità.
- Cybersecurity: Con la crescente connettività dei dispositivi medici, garantire la sicurezza dei dati e la protezione dalle minacce informatiche diventa fondamentale. L'integrazione di solide misure di sicurezza informatica e l'aggiornamento sulle migliori pratiche per la sicurezza dei dispositivi sono considerazioni fondamentali per le operazioni di regolamentazione.
- Sfide varie: Tra queste, le complessità della catena di fornitura globale, come l'approvvigionamento delle materie prime, la disponibilità dei componenti e i processi di produzione, che pongono problemi nel mantenere la conformità alle normative e nel garantire la qualità dei prodotti. Per affrontare queste sfide e mitigare i rischi associati sono essenziali solide pratiche di gestione della catena di fornitura, valutazioni del rischio e supervisione dei fornitori.
Per orientarsi nel panorama normativo dei prodotti combinati farmaceutici-dispositivi è necessaria una comprensione approfondita del quadro normativo, delle linee guida recenti e delle migliori pratiche. Affrontare le considerazioni chiave, rimanere aggiornati sui cambiamenti e implementare le migliori pratiche aiuterà le aziende farmaceutiche a semplificare le loro operazioni normative. La collaborazione con fornitori di servizi normativi consente alle aziende di sfruttare conoscenze ed esperienze specializzate e ottimizzare le loro possibilità di successo normativo in questo campo in continua evoluzione e molto esigente. Grazie alla nostra comprovata esperienza nel rispetto delle norme normative globali, Freyr può aiutare a garantire la conformità dei prodotti. Per saperne di più, us.









