
Per migliorare l'accessibilità dei farmaci innovativi per i pazienti nel Regno Unito dopo la Brexit, nel gennaio 2021 è stato lanciato un nuovo percorso di approvazione accelerato denominato Innovative Licensing and Access Pathway (ILAP). Il suo obiettivo principale era quello di fornire una tabella di marcia integrata per tutte le parti interessate che migliorasse il processo di sviluppo dei prodotti. L'ILAP sostiene ulteriormente gli sviluppatori commerciali e non commerciali facilitando l'accesso dei farmaci innovativi alla popolazione di pazienti grazie alla riduzione dei tempi di immissione sul mercato. Le aziende farmaceutiche possono prendere in considerazione l'ILAP come percorso una volta consolidati i dati non clinici. È applicabile alle nuove entità chimiche (NCE), ai farmaci biologici, alle nuove indicazioni e ai farmaci riproposti.
L'ILAP è un'iniziativa sviluppata congiuntamente dall'Agenzia di regolamentazione dei medicinali e dei prodotti sanitari (MHRA) in collaborazione con l'All-Wales Therapeutics and Toxicology Centre (AWTTC), il National Institute of Health and Care Excellence (NICE) e lo Scottish Medicines Consortium (SMC) in qualità di partner permanenti. Tra i partner che sostengono l'ILAP figurano il Servizio sanitario nazionale inglese (NHS), l'Autorità per la ricerca sanitaria (HRA) e l'Istituto nazionale per la ricerca sanitaria (NIHR). Insieme, le parti interessate forniscono un contributo migliorato in materia di regolamentazione, scienza, etica e commercio nella fase iniziale dello sviluppo dei medicinali durante le sperimentazioni cliniche.
Secondo Freyr, l'ILAP offre grandi opportunità agli sviluppatori di trattamenti innovativi, in particolare a quelli che rispondono alle esigenze non soddisfatte dei pazienti. Con una spesa relativamente modesta (circa 8000 sterline), un'azienda può ottenere consulenza nella fase iniziale, ottenere una designazione per il proprio prodotto e concordare un profilo di sviluppo target. Ciò consente di risparmiare una notevole quantità di tempo nell'intero ciclo di vita dello sviluppo del prodotto. Ci sono anche vantaggi nel guardare oltre l'autorizzazione all'immissione in commercio e nel prepararsi per tempo alle trattative sul rimborso.
L'ILAP è paragonabile a programmi simili offerti dalla rete europea dei medicinali (come il PRIME). Sebbene diverso per concetto e modalità di attuazione, l'ILAP ha criteri di accettazione più ampi e un tasso di accettazione più elevato. L'ILAP offre inoltre un percorso di integrazione con il progetto Orbis della Food and Drug Administration (USFDA) statunitense per i prodotti oncologici emergenti.
Come fare domanda per l'ILAP?
Per accedere all'ILAP, i richiedenti devono richiedere un Passaporto dell'Innovazione (IP). Ottenere la designazione IP consente agli sviluppatori di farmaci di accedere al percorso sulla base delle prove richieste affinché un prodotto sia conforme ai criteri di ammissibilità definiti dal NICE, dall'SMC, dall'AWTTC e MHRA.
Questa designazione funge da catalizzatore per i prodotti innovativi dalla fase preclinica a quella intermedia di sviluppo. La PI può portare alla definizione di un documento Target Development Profile (TDP). Il TDP è una tabella di marcia che facilita l'accesso ai partner ILAP nelle prime fasi del ciclo di vita del farmaco, per accelerare e velocizzare l'accesso dei pazienti a trattamenti nuovi e innovativi. I pazienti fanno parte dell'intero processo. Diversi strumenti forniti dall'ILAP supportano i richiedenti in tutte le fasi del processo di progettazione, sviluppo e approvazione.
Criteri di designazione del passaporto innovativo
MHRA chiarisce i criteri per la designazione IP. Ciò è particolarmente rilevante per i prodotti innovativi e risulta vantaggioso rispetto a programmi equivalenti offerti in Europa.
In futuro, l'applicabilità specifica della PI ai dispositivi medici e ai prodotti combinati, settori in cui l'innovazione è sempre significativa, potrà rivelarsi vantaggiosa.
La designazione della PI viene valutata dai partner permanenti e di supporto sulla base dei seguenti criteri:
- Criteri 1: dettagli sulla condizione, sul paziente o sull'area di salute pubblica
- Per condizioni gravi e pericolose per la vita
- In un evento in cui la necessità è fondamentale per i pazienti
- Criterio 2: Il medicinale soddisfa una o più aree specifiche che comprendono
- Medicina innovativa
- Farmaci associati a una nuova indicazione
- Medicina per le malattie rare
- Farmaci in fase di sviluppo per l'obiettivo della salute pubblica del Regno Unito
- Criterio 3: Il farmaco ha il potenziale per offrire
- Una breve descrizione del modo in cui il farmaco o l'indicazione proposta apporteranno benefici ai pazienti.
- I pareri dei pazienti o delle organizzazioni di pazienti sono incoraggiati.
Al momento della presentazione della domanda IP, MHRA un incontro tra i richiedenti e MHRA per verificare se il prodotto soddisfa i tre (03) criteri.
Secondo le ultime informazioni di gennaio 2022, la MHRA ha ricevuto settantuno domande, di cui quarantuno hanno portato alla designazione IP, ventidue sono in fase di elaborazione e sette domande sono state rifiutate.
Il momento giusto per entrare nell'ILAP è indicato di seguito.
- Nella fase iniziale e intermedia di sviluppo del prodotto
- Quando sono disponibili dati rilevanti
- Quando i richiedenti sentono la necessità di ottenere i contributi delle parti interessate
- I candidati aspirano ad adottare nuovi approcci innovativi
- Non quando il prodotto è verso la fine della fase di sviluppo.
Panoramica dello sviluppo dei farmaci
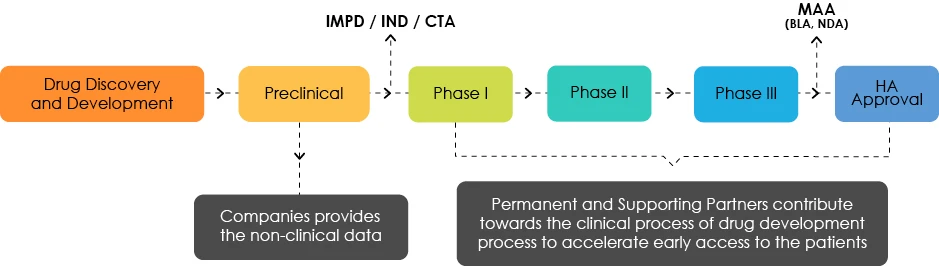
Comprendere il Profilo di Sviluppo del Target (TDP)
Gli esperti TDP analizzano le caratteristiche del prodotto ed evidenziano le carenze dal punto di vista regolatorio. Hanno il compito di indirizzare gli sviluppatori di farmaci verso una tabella di marcia che consenta un accesso precoce dei pazienti ai loro prodotti.
La TDP è un documento che viene aggiornato in tempo reale in base ai requisiti allineati allo sviluppo del prodotto. Per questo motivo, un prodotto viene sottoposto a più modifiche della TDP man mano che vengono generati nuovi dati.
L'accessibilità dei pazienti ai farmaci essenziali può essere compromessa dai ritardi del mercato. Per evitare tali scenari, i percorsi accelerati fungono da catalizzatore. L'ILAP è un esempio di percorso di autorizzazione flessibile ben accettato in tutto il settore e in grado di accelerare i tempi di sviluppo di farmaci innovativi. I criteri dettagliati definiti dal sistema sanitario del Regno Unito consentono ai richiedenti di verificare la propria idoneità a richiedere la designazione IP. Incentivare le esigenze cliniche e dei pazienti non soddisfatte con percorsi accelerati come l'ILAP facilita l'ingresso sul mercato e può fornire sollievo alle popolazioni di pazienti a rischio. Per salvaguardare l'interesse dei pazienti, le autorità sanitarie non scendono a compromessi in materia di sicurezza, efficacia o qualità del prodotto, garantendo al contempo un processo di approvazione accelerato.I servizi normativi end-to-end di Freyr facilitano il processo di documentazione a supporto della designazione Innovative Passport in tempi rapidi, aiutando i vostri prodotti a reach prima. Contattate Freyr.









