
Un nuovo rapporto di un'associazione europea di categoria dei farmaci generici afferma che le politiche di contenimento dei costi estremi possono influire negativamente sulla catena di fornitura dei farmaci generici, provocando il consolidamento della produzione di farmaci generici e il ritiro di tali prodotti dal mercato. Un recente comunicato stampa di Medicines for Europe afferma inoltre che è dimostrato che le politiche di contenimento dei costi estremi stanno producendo effetti controproducenti sui farmaci generici. Anche il mercato dell'Unione Europea (UE) sta affrontando un rischio di ritiro di farmaci importanti e meno costosi.
Datato 23 novembre 2021, il rapporto fa riferimento al European Commission del 2018, che offre una protezione brevettuale fino a tredici (13) anni per i farmaci innovativi. I certificati protettivi complementari per i principi attivi farmaceutici (API) per altri cinque (05) anni estendono la protezione degli API sul mercato dell'UE fino a un totale di venticinque (25) anni. Durante questo periodo, il prezzo del prodotto rimane invariato ed è protetto dai prodotti concorrenti.
I produttori che preferiscono l'innovazione fuori brevetto la trovano un'alternativa economicamente vantaggiosa. Sebbene il costo totale dei prodotti fuori brevetto sia circa/più della metà di quello dello sviluppo di un farmaco de novo (una progettazione di farmaci che implica un processo iterativo in cui la struttura tridimensionale del recettore viene utilizzata per progettare nuove molecole), si sta rivelando un'opzione migliore.
La maggior parte dei produttori di farmaci sta trovando nel riposizionamento dei farmaci l'opzione ideale nell'innovazione post-brevetto. Si tratta di un processo in cui i farmaci esistenti vengono studiati per identificare nuovi usi terapeutici. Conosciuta anche come riposizionamento dei farmaci, diverse aziende farmaceutiche stanno sviluppando nuovi farmaci utilizzando questa strategia efficiente, che fa risparmiare tempo e costi.
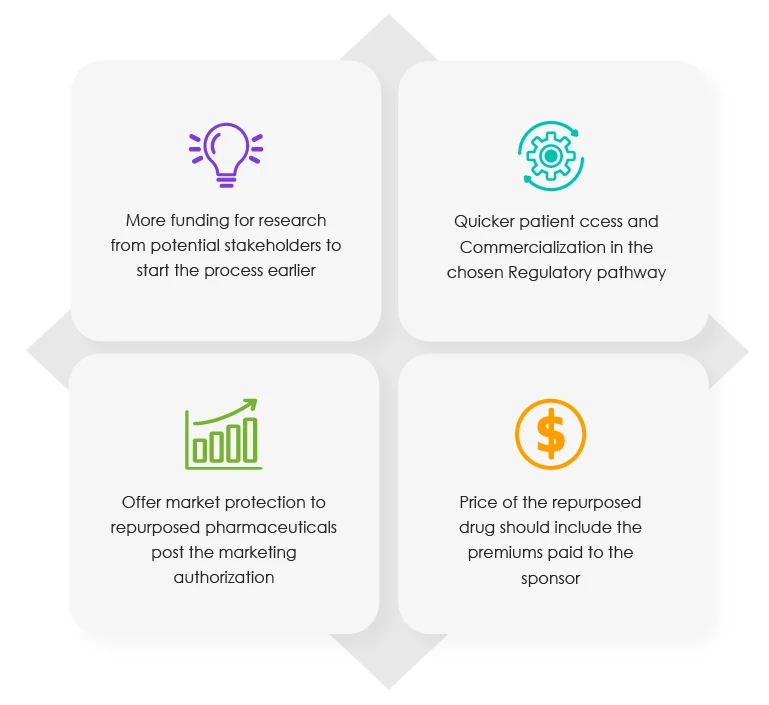
La relazione della Commissione del 2018 contiene il protocollo da seguire per il riposizionamento dei farmaci. Include anche gli incentivi normativi disponibili per i titolari di autorizzazione all'immissione in commercio (MAH) di determinati farmaci. Secondo l'ultimo rapporto della suddetta associazione di categoria, nelle diverse fasi del processo di riproposizione/riposizionamento dovrebbero essere offerti i seguenti quattro (04) vantaggi.
Incentivi proposti per gli sponsor nelle diverse fasi del processo di riposizionamento
Per incoraggiare l'innovazione fuori brevetto nel mercato dell'UE, nel recente passato è stato fatto molto lavoro. Tra questi, la creazione di un quadro pubblico-privato per il repurposing dei farmaci da parte di un team di esperti. Il presente rapporto si basa su questo quadro, lanciato nell'ottobre 2021. L'obiettivo è sfruttare al meglio la fonte di innovazione non sfruttata nel settore farmaceutico per soddisfare la domanda insoddisfatta di farmaci salvavita.
Se sei un produttore di farmaci generici che desidera entrare nel mercato dell'UE, informazioni tempestive sugli ultimi aggiornamenti normativi e la consulenza di un partner come Freyr aiutarti ad adottare le migliori procedure di conformità e a risparmiare sui costi. Rimani informato. Rimani conforme.









