
RISPETTO DELLA SCADENZA IDMP ENTRO LUGLIO 2016: UN IMPEGNO NON TRIVIALE
Ci sono molte domande IDMP : dove si trovano i dati in un'organizzazione? È necessario pulire e allineare i dati attuali? In che modo le aziende organizzano questi dati per facilitarne il recupero e l'invio? L'organizzazione dispone di processi che possono trarre vantaggio da un archivio centrale?
Raggiungere la conformità all'Identificazione dei Prodotti Medicinali (IDMP) non è un'impresa da poco; l'attività deve tenere conto di diverse pressioni normative e operative. Le organizzazioni devono attendere che le autorità emettano le linee guida finali e approvino le specifiche. Allo stesso tempo, attendere queste linee guida potrebbe non lasciare loro tempo sufficiente per mettere in ordine i loro affari.
IDMP è uno standard complesso con implicazioni sui dati di vasta portata che richiede collaborazione e cooperazione tra molte unità interfunzionali. La transizione offre l'opportunità di esaminare in modo End-to-End i processi aziendali e le capacità IT di un'organizzazione attraverso molte unità funzionali. Aiuta anche a stabilire un solido sistema di gestione del cambiamento.
Le organizzazioni devono comprendere che una buona architettura delle informazioni richiede impegno e tempo per essere realizzata e devono anche riconoscere che IDMP non IDMP semplicemente un XEVMPD più grande. È inoltre importante notare che ICH sono solo una parte del quadro e che la disponibilità di linee guida regionali è fondamentale. Si deve anche tenere presente che le implementazioni regionali parallele avranno ambiti e tempistiche diversi, con un'ampia varietà di fornitori di dati.
Inoltre, le aziende farmaceutiche che intendono commercializzare i propri prodotti in regioni regolamentate devono IDMP a partire dal 2016. Recentemente EMA una giornata IDMP e ha condiviso lo stato IDMP dell'implementazione e le tempistiche IDMP . Dopo aver discusso con l'industria farmaceutica e i fornitori di software e aver analizzato la disponibilità dei propri sistemi e risorse, EMA pianificato di suddividereIDMP complessivaIDMP in più iterazioni. Questo piano sarà sottoposto all'approvazione European Commission CE) e, se riuscirà a convincerla, IDMP nell'UE sarà distribuita tra il 2016 e il 2018. Nel peggiore dei casi, se la CE non dovesse accettare, non esiste un piano B. Le sanzioni per la non conformità ammontano fino al 5% del fatturato di un'organizzazione; non disporre di una buona soluzione per IDMP iniziale e continua IDMP è un rischio che nessuna azienda farmaceutica può permettersi di correre.
IDMP: SVILUPPATO COME INSIEME DI NORME GLOBALI NELL'AMBITO DELL'ISO
Nel caso in cui debba essere introdotta una legislazione sull'identificazione dei medicinali in uno qualsiasi dei paesi ISO, ciò avverrà in base agli standard ISO IDMP. Una volta che diverse regioni adotteranno gli standard IDMP, l'inserimento dei dati sarà coerente e a loro volta le aziende globali e le autorità di regolamentazione avranno accesso per verificare la coerenza dei dati tra le regioni. Inoltre, vocabolari controllati comuni faciliteranno notevolmente questo processo.
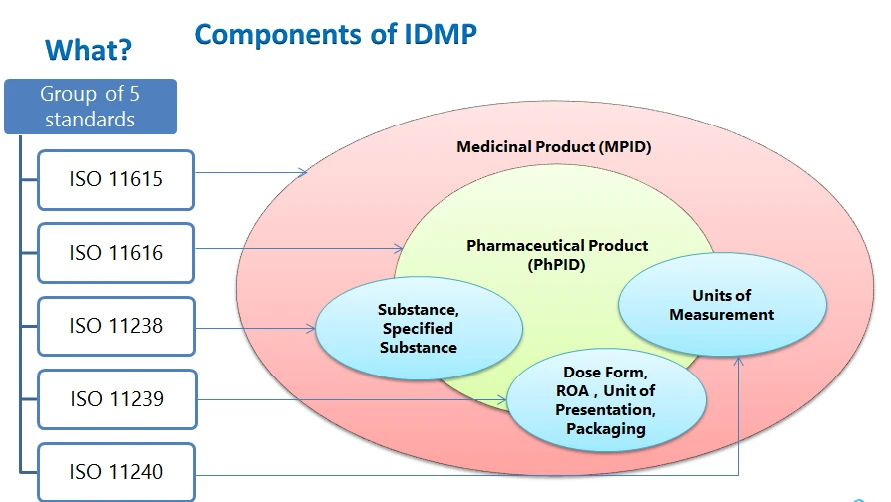
Gli elementi strutturali IDMP l'identificativo del medicinale, l'identificativo del prodotto farmaceutico, l'identificativo della sostanza, i vocabolari controllati (forma di dosaggio, via di somministrazione, componenti dell'imballaggio, unità di presentazione, unità di misura) e la descrizione del processo di fabbricazione da presentare.
IDMP
- ISO 11615 - Informazioni sui medicinali
- ISO 11616 - Informazioni sui prodotti farmaceutici
- ISO 11238 - Sostanze
- ISO 11239 - Forme di dosaggio farmaceutiche, unità di presentazione, vie di somministrazione e confezionamento
- ISO 11240 - Unità di misura
STATO ATTUALE
ICH preparando delle guide all'implementazione e sta rivedendo gli standard ISO.
LE AUTORITÀ DI REGOLAMENTAZIONE DELL'UE SI PREPARANO ALL'IDMP
- EMA avviato una collaborazione con la rete normativa dell'UE per definire i casi aziendali per i IDMP .
- EMA istituendo un "IDMP force ISO IDMP dell'UE reclutando esperti dai EMA e dal comitato per i dati dell'UE per raggiungere questo obiettivo. Nello specifico:
- Definire gli elementi IDMP ISO IDMP obbligatori e facoltativi
- Definire le regole aziendali per gli elementi di dati opzionali
- Definire la conformità e i tipi di dati
- Definire i modelli di governance dell'UE
POSIZIONE US
- Leadership attiva nel IDMP con le autorità di regolamentazione globali (ex ICH) e con l'ISO
ALTRI REGOLATORI
- Svizzera - Intende implementare dopo l'UE (fast follower)
- Giappone e Canada hanno nominato i regolatori come esperti del gruppo Substance IG
TEMPISTICHE
GUIDE DI IMPLEMENTAZIONE EUROPEE
- La bozza delle guide di implementazione è stata avviata e le guide saranno disponibili a partire dal primo trimestre del 2016.
ALTRI
- FDA ancora FDA una data, ma intende sviluppare SPL secondo necessità.
- Giappone – Incerto ICH ora sta lavorando all'interno del gruppo di regolamentazione e dell'ISO
- Canada - Si prevede l'implementazione, ma non ci sono ancora specifiche.
- Svizzera - Non ci sono ancora aggiornamenti
COMPRENDERE I REQUISITI IDMP
IDMP richiede informazioni sui prodotti medicinali in termini di un insieme di identificatori standard, che si basano su una gerarchia di identificazione creata durante la costruzione del Dizionario dei Prodotti Medicinali EudraVigilance (EVMPD) o nella sua forma estesa (xEVMPD). Ci sarà una sovrapposizione di informazioni con quelle depositate nelle registrazioni Structured Product Labeling (SPL) negli US e in altri registri di prodotti a livello globale.
Tuttavia, IDMP nuovi identificatori, nuove categorie e nuovi modi per esprimere le relazioni tra gli elementi nel modello di dati. IDMP essere integrato nel DNA dell'organizzazione, poiché deve guidare la costruzione dei modelli di dati in tutta l'azienda. L'infrastruttura IT di un'organizzazione può quindi riconoscerlo in più sistemi, processi aziendali e unità funzionali come RA, Sicurezza, R&S, documentazione e processi di produzione.
SFIDE IDMP
Organizzazione
- Dati distribuiti tra più reparti
- È necessaria una sponsorizzazione senior per incoraggiare la partecipazione
Tecnica
- Scoprire, raccogliere e consolidare dati puliti
- 250-300 campi per prodotto
Co
- Gestione del cambiamento continuo
- Co tra più team
- Mantenimento della normativa sui dati con processo interno
IN CONCLUSIONE:
IDMP: IMPATTO SULL'INDUSTRIA FARMACEUTICA
L'implementazione degli IDMP dovrebbe avere un impatto sulla preparazione e la pianificazione delle richieste di registrazione e sulla gestione dei dati aziendali, compresi i dati di produzione e le informazioni strutturate sulle sostanze, fino alle informazioni di registrazione.
IDMP : MAGGIORE EFFICIENZA GARANTITA DOPO L'IMPLEMENTAZIONE
Per garantire che la vostra organizzazione sia pronta ad affrontare la IDMP sarà necessaria una stretta collaborazione tra più reparti all'interno della vostra organizzazione. Un fornitore di servizi competente con un portafoglio esclusivo di competenze normative può aiutare a raggiungere IDMP , consentendo all'organizzazione di rispondere alle nuove opportunità in evoluzione sul mercato.









