
La necessità di farmaci salvavita è in costante aumento. A causa delle nuove malattie mortali, produttori di farmaci produttori investendo molto tempo e denaro nella ricerca e nello sviluppo di farmaci chimici e biologici. Per quanto sia difficile inventare farmaci innovativi, per produttori può essere altrettanto scoraggiante produttori . Dalla preparazione e presentazione della domanda di autorizzazione all'uso sperimentale di un nuovo farmaco (IND) alle domande di sperimentazione clinica (CTA) e alle autorizzazioni all'immissione in commercio (MA), è necessario seguire una serie di procedure normative, come prescritto dalle rispettive autorità sanitarie (HA).
I produttori devono fare le cose per bene la prima volta affinché i farmaci innovativi raggiungano il mercato senza ritardi. Ciò contribuirà a soddisfare la domanda di farmaci salvavita in mercati specifici e a garantire il Ritorno sull'Investimento (ROI) per i produttori.
La necessità di soluzioni normative migliorate e processi conformi è quindi fondamentale. Ci sono diversi motivi per cui produttori non produttori in grado di seguire il percorso appropriato.
Sfide normative affrontate dai produttori di farmaci innovatori
- Mancanza di comprensione delle complessità normative
- Conoscenza limitata delle varie fasi di presentazione delle domande da inoltrare alle autorità di vigilanza.
- Tempistiche per la presentazione dei dossier medici, del documento tecnico comune (CTD), dei rapporti di studio clinico (CSR), ecc.
- Differenze nelle normative quando i farmaci devono essere venduti a livello globale
- Mancanza di preparazione per affrontare eventuali problemi o difficoltà che si presentano nella fase di produzione
Vantaggi della collaborazione con il giusto fornitore di servizi/soluzioni normative:
Il partner giusto garantirà che tutte le fasi di produzione dei farmaci siano conformi agli organismi regolatori competenti e che portino a presentazioni tempestive.
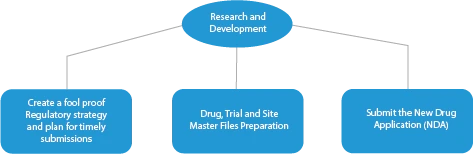
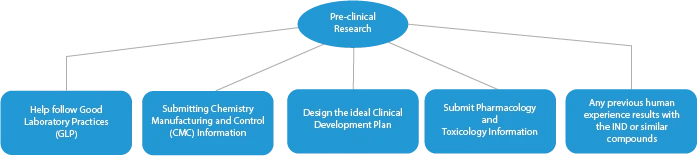
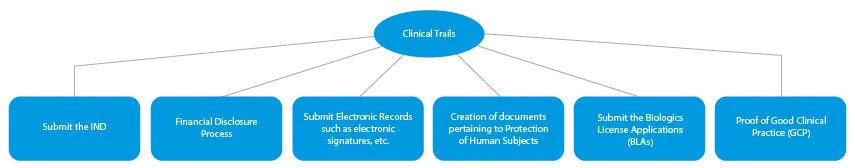
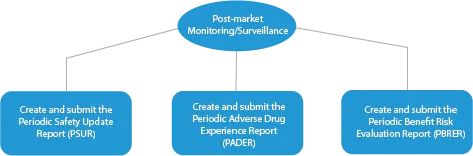
Le fasi di produzione di un farmaco innovativo sono quattro (04). Queste sono le seguenti:
- Ricerca e sviluppo
- Ricerca preclinica/sperimentazioni
- Sperimentazioni cliniche
- Monitoraggio/sorveglianza post-vendita
Ogni fase dello sviluppo di un farmaco richiede una serie di documenti che devono essere presentati alle autorità competenti. Ecco una descrizione di come un fornitore di servizi regolatori affermato possa aiutare in tutte le fasi.
Parola finale
Con l'aumento dell'aspettativa di vita della popolazione mondiale, è necessario scoprire nuovi farmaci. L'innovazione nel campo delle scienze della vita ha portato a diverse invenzioni di farmaci salvavita. Molti di essi si trovano in varie fasi di produzione. Qualunque sia la fase in cui si trova il vostro prodotto, collaborare con un fornitore di servizi normativi globale come Freyr, che ha esperienza nella registrazione di farmaci innovativi, può aiutarvi a evitare la non conformità e garantire che i nuovi farmaci reach mercato in tempo. Rimanete informati. Rimanete conformi.









