
Negli ultimi tempi, la comparsa di impurità di nitrosammina in alcune sostanze di farmaci generici ha indotto a rivalutare le pratiche del settore. Questo blog fa un'immersione profonda nel mondo sfaccettato della mitigazione delle nitrosammine, in particolare nel contesto dei prodotti farmaceutici generici. Inoltre, fa luce anche sulle considerazioni fatte per le impurità correlate alle sostanze farmaceutiche nitrosammina. Esploriamo le complessità del mantenimento della qualità, della garanzia della bioequivalenza e della comprensione del ruolo fondamentale degli esperti regolatori in questo processo critico.
La sfida delle nitrosammine: Un appello all'azione normativa
Le nitrosammine, una classe di composti noti per essere potenziali agenti cancerogeni, rappresentano una sfida normativa complessa. Le agenzie di regolamentazione, tra cui la FDA statunitense FDA l'Agenzia europea per i medicinali (EMA), hanno risposto con limiti e linee guida rigorosi per la presenza di queste impurità nei prodotti farmaceutici. Ciò richiede un approccio globale per comprendere, individuare e mitigare il rischio di impurità da nitrosammine nei farmaci generici.
Sfide della bioequivalenza nei prodotti generici: Bilanciare sicurezza ed equivalenza
La bioequivalenza è la pietra miliare dello sviluppo dei farmaci generici, in quanto garantisce che un prodotto generico sia terapeuticamente equivalente alla sua controparte di riferimento. Questo aspetto critico diventa ancora più complesso nel contesto dell'attenuazione delle impurità legate alle nitrosammine.
1. Garantire la coerenza della formulazione
La presenza di impurezze di nitrosammina incide sulla consegna costante dell'ingrediente farmaceutico attivo (API) al paziente. Gli esperti di regolamentazione, in collaborazione con gli scienziati della formulazione, svolgono un ruolo fondamentale nel garantire che qualsiasi modifica apportata per ridurre le impurità non comprometta la stabilità o l'efficacia della formulazione.
2. Impatto su assorbimento e farmacocinetica
Le impurità di nitrosamina possono potenzialmente influenzare l'assorbimento e la farmacocinetica del farmaco. Questo aspetto è particolarmente preoccupante nel contesto dei prodotti generici, dove sottili variazioni possono avere effetti pronunciati. Gli esperti di regolamentazione guidano questi studi per garantire che siano conformi agli standard normativi e forniscano indicazioni significative sulla sicurezza e l'efficacia del prodotto generico.
3. Studi di dissoluzione: Una componente chiave
Le impurità di nitrosammina possono influenzare i tassi di dissoluzione e gli esperti normativi lavorano a stretto contatto con i team di formulazione e di analisi per sviluppare e implementare solidi metodi di test di dissoluzione. Questi metodi devono essere sufficientemente sensibili da rilevare le variazioni nei profili di dissoluzione che possono verificarsi a causa della presenza di impurità.
4. Monitoraggio e vigilanza post-approvazione
Anche dopo l'approvazione normativa, il monitoraggio dei prodotti generici per la presenza di impurità di nitrosammine continua. Gli studi post-approvazione e gli sforzi di farmacovigilanza sono guidati da esperti normativi che collaborano con i produttori per implementare solidi programmi di monitoraggio. Questa vigilanza continua è cruciale per identificare e affrontare tempestivamente qualsiasi preoccupazione emergente sulla sicurezza associata alle impurità di nitrosammine.
Il ruolo degli esperti normativi: Navigare in un panorama complesso
I professionisti degli affari regolatori svolgono un ruolo fondamentale nel mitigare le sfide poste dalle impurità legate alla nitrosamina nei prodotti farmaceutici generici. Le loro molteplici responsabilità si estendono a vari ambiti e sono illustrate nel grafico a torta sottostante:
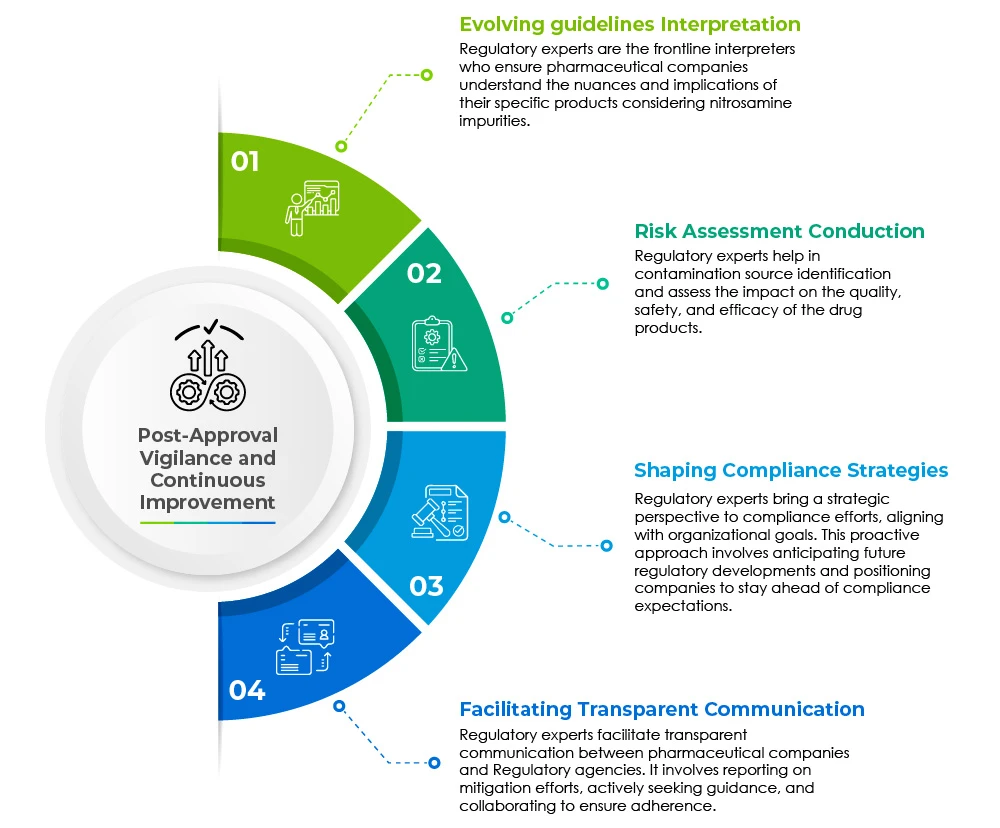
La vigilanza post-approvazione e il miglioramento continuo sono le pietre miliari per una rapida assistenza normativa.
Conclusioni: Salvaguardia della salute pubblica attraverso la vigilanza e la competenza
La riduzione delle impurità correlate alle nitrosammine non è solo un requisito normativo, ma anche un impegno nei confronti della salute pubblica. Mentre l'industria farmaceutica affronta questa sfida, il ruolo degli esperti in materia di regolamentazione diventa fondamentale. La loro capacità di coniugare la conformità con l'innovazione garantisce che i farmaci generici non solo soddisfino gli standard normativi, ma contribuiscano anche a un futuro più sicuro e più sano. In Freyr, i nostri esperti in materia di regolamentazione sfruttano le loro competenze per ottenere un vantaggio competitivo in tali attività per le aziende farmaceutiche. us per saperne di più.









