
I farmaci generici competitivi sono noti per essere un vantaggio in quanto aprono la strada a un mercato redditizio, a condizione che i produttori di farmaci possano decifrare lo sviluppo di farmaci impegnativo e complicato. Sebbene le tecnologie di sviluppo dei farmaci siano in continua evoluzione, dobbiamo ancora comprendere i risultati della Terapia Generica Competitiva (CGT). Quando si discute del carico di malattia, la dimensione e il volume della demografia della popolazione di pazienti sono stati elementi critici per lo sviluppo e l'approvazione dei farmaci. Tuttavia, nelle aree terapeutiche in cui la concorrenza generica è quasi trascurabile, il costo della terapia rimane invariabilmente elevato a causa della mancanza di concorrenza. Per facilitare la concorrenza in aree terapeutiche di nicchia dopo il United States Food and Drug Administration (US FDA) Reauthorization Act 2017, un farmaco può ottenere la designazione di “concorrenza generica inadeguata” come parte della CGT.
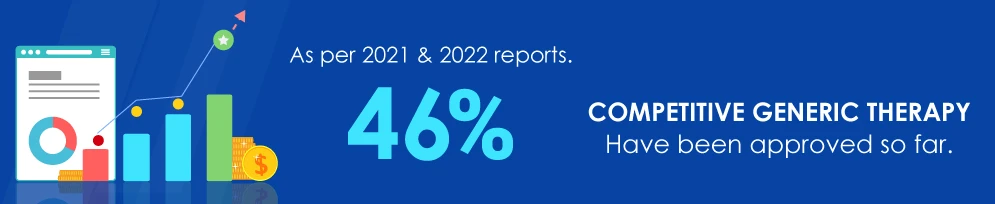
Fonte dei dati: fda
FDA US FDA consapevole dei fattori che possono influenzare la decisione di un richiedente di sviluppare un farmaco generico. Ad esempio, il farmaco "X" appartenente a una categoria terapeutica di nicchia potrebbe non suscitare un elevato interesse da parte dei richiedenti di farmaci generici se confrontato direttamente con il farmaco "Y", che serve un gruppo di pazienti più ampio. Ciò può verificarsi quando il mercato dei prodotti di nicchia è limitato e/o se i prodotti sono più difficili da sviluppare. La difficoltà di sviluppo può variare da mercati altamente regolamentati a procedure di produzione complesse con un aumento della domanda di fondi. Se gestite correttamente, le aree terapeutiche di nicchia possono svolgere un ruolo significativo nella diagnosi, nel trattamento e nella prevenzione di vari tipi di malattie o condizioni. Le disposizioni relative alle CGT hanno lo scopo di incentivare lo sviluppo mirato, la revisione efficiente e l'ingresso tempestivo sul mercato di farmaci per i quali la concorrenza dei farmaci generici è inadeguata.
Per facilitare una maggiore concorrenza per questi prodotti, la FDA intraprendere determinate azioni per accelerare lo sviluppo e la revisione di una domanda abbreviata di autorizzazione all'immissione in commercio (ANDA) per un farmaco designato come CGT. Queste azioni della FDA contribuire a chiarire le aspettative normative per un particolare farmaco, aiutare i richiedenti a sviluppare una domanda completa e, in ultima analisi, promuovere un processo ANDA più efficiente ed efficace per ridurre il numero di cicli di revisione necessari per ottenere ANDA . Un richiedente può presentare una richiesta affinché un farmaco ottenga la designazione CGT. La FDA il processo attraverso il quale a un farmaco viene concessa la designazione specifica per una particolare domanda e un particolare prodotto farmaceutico, come interpretato nella sezione 506H. La guida CGT fornisce una lista di controllo che consente ai richiedenti di effettuare un livello primitivo di autovalutazione.
Lista di controllo per qualificarsi per la designazione esclusiva CGT:
- Presenza di generici inadeguati per una molecola secondo l'Orange Book
- Richiesta di designazione di un farmaco come CGT
- Richiesta di designazione CGT da indicare prima della ANDA
In un segmento terapeutico in cui la concorrenza è inadeguata, l'indisponibilità di numerosi marchi tra cui scegliere diventa un collo di bottiglia. Il tempo è essenziale per eliminare tali ostacoli in segmenti terapeutici isolati con tempistiche critiche per il trattamento dei pazienti. L'iniziativa FDAdi concedere un farmaco innovativo con una CGT garantisce un afflusso continuo di molecole essenziali o rare sul mercato per ridurre i costi di trattamento. Gli esperti di Freyr familiarità con i requisiti aggiornati indicati nella guida CGT e possono aiutare a identificare se tale percorso è adatto al vostro farmaco. Provate voi stessi la perfezione. us oggi stesso.









