
Le Autorizzazioni all'Uso di Emergenza (EUA) sono significative nel rendere i prodotti medicinali salvavita disponibili ai pazienti più rapidamente. Sono state utili nella gestione di pandemie come il COVID-19. Un'iniziativa della USFDA (United States Food and Drug Administration) avviata nel 2004, l'EUA è entrata in vigore quando la Sezione 564 del Federal Food, Drug, and Cosmetic Act è stata modificata dal Project BioShield Act. Questo programma è un'iniziativa intrapresa dalla FDA per proteggere la salute pubblica garantendo la sicurezza, l'efficacia e la qualità dei prodotti medici, affrontando al contempo le emergenze mediche e le minacce emergenti alla salute pubblica.
Comprendiamolo meglio nelle righe seguenti.
Decodificare l'EUA
Il percorso EUA è un mezzo per facilitare l'accessibilità delle contromisure mediche in tempi di emergenze dichiarate. Il Commissario della FDA può autorizzare quanto segue in tali situazioni:
- L'uso autorizzato di prodotti medici non approvati.
- L'uso non autorizzato di prodotti medici approvati.
I prodotti coperti dall'EUA includono vaccini, fluidi endovenosi, farmaci, dispositivi, test, ecc. e possono essere utilizzati per diagnosticare, trattare o prevenire condizioni di pericolo di vita. L'EUA viene concessa ai prodotti che soddisfano i seguenti criteri:
- Prova di una condizione/malattia pericolosa per la vita.
- I dati scientifici forniscono prove sufficienti dell'efficacia del prodotto per l'uso previsto.
- I benefici del prodotto sono superiori ai rischi (ovvero prove di sicurezza).
- Mancanza di prodotti alternativi.
Si consiglia agli sponsor di comprendere in anticipo i requisiti della FDA in modo da seguire il miglior processo normativo e garantire una presentazione EUA senza errori. Di seguito sono riportate le informazioni obbligatorie che devono essere condivise dallo sponsor nella domanda.
Dati da presentare dallo Sponsor alla FDA per un'Approvazione EUA
- Descrizione del prodotto e sua destinazione d'uso.
- Lo stato di approvazione del prodotto presso la FDA.
- Informazioni sulla sicurezza e sull'efficacia, come dati clinici e non clinici, ecc.
- Relazione sull'analisi rischi-benefici.
- Dati di chimica, produzione e controlli (CMC).
- Informazioni su dosaggio, controindicazioni, avvertenze ed eventi avversi per la distribuzione del prodotto medico in questione.
Come vengono rilasciate le EUA dalla FDA?
Di seguito è riportata un'interpretazione diagrammatica del ciclo di vita dell'EUA in breve:
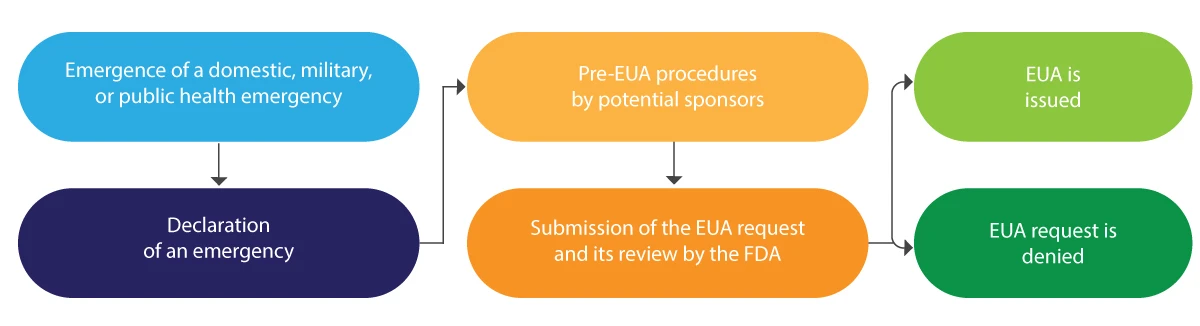
L'EUA viene tipicamente rilasciata per un periodo limitato e, al termine della suddetta emergenza, viene revocata dalla FDA.
EUA e COVID-19
Il Segretario della Salute e dei Servizi Umani (HHS) ha dichiarato il COVID-19 una pandemia il 31 gennaio 2020. Da allora, la FDA è stata fondamentale nell'approvare alcuni vaccini e kit di test domiciliari nell'ambito del percorso EUA per affrontare l'epidemia globale in corso.
Con la comparsa di nuove varianti del COVID-19, l'intero settore farmaceutico sta lavorando alacremente per contenere la diffusione e ridurre i tassi di mortalità. È necessario disporre di nuovi prodotti medicinali e di approvazioni più rapide da parte delle autorità di regolamentazione globali, in modo da ridurne il tempo di immissione sul mercato. Secondo gli esperti, la strada da seguire è quella dell'EUA (Emergency Use Authorization, autorizzazione all'uso di emergenza) per la registrazione di nuovi prodotti medicinali/farmaci. Anche diverse altre autorità sanitarie, come l'Agenzia europea per i medicinali (EMA), la Central Drugs Standard Control Organization CDSCO), la Saudi Food and Drug Authority SFDA), ecc., hanno implementato la procedura EUA per accelerare le approvazioni.
Se siete un produttore di farmaci e cercate un'EUA per il vostro prodotto salvavita, avrete bisogno di un fornitore esperto di soluzioni normative. Rivolgetevi a Freyr per un tempo di immissione sul mercato più rapido e un percorso conforme.









