
Le aziende farmaceutiche alla ricerca di nuove prospettive commerciali trovano nella Corea del Sud un mercato interessante con un'industria farmaceutica in rapida crescita. Con oltre novecento (900) nuovi farmaci in cantiere ed esportazioni per un totale di 3,1 miliardi di dollari, la Corea del Sud offre un enorme potenziale per la produzione di grandi farmaci.
In Corea del Sud, la presentazione di una Domanda per un Nuovo Farmaco (NDA) o di una Domanda di Licenza per Prodotti Biologici (BLA) è un passo fondamentale per l'immissione sul mercato di nuovi prodotti farmaceutici. Il Ministero della Sicurezza Alimentare e Farmaceutica (MFDS) è responsabile della revisione e dell'autorizzazione di NDA e BLA in Corea del Sud. La procedura di revisione può richiedere fino a centottanta giorni, ma se il farmaco è designato come revisione prioritaria o farmaco fast-track, i tempi possono essere abbreviati.
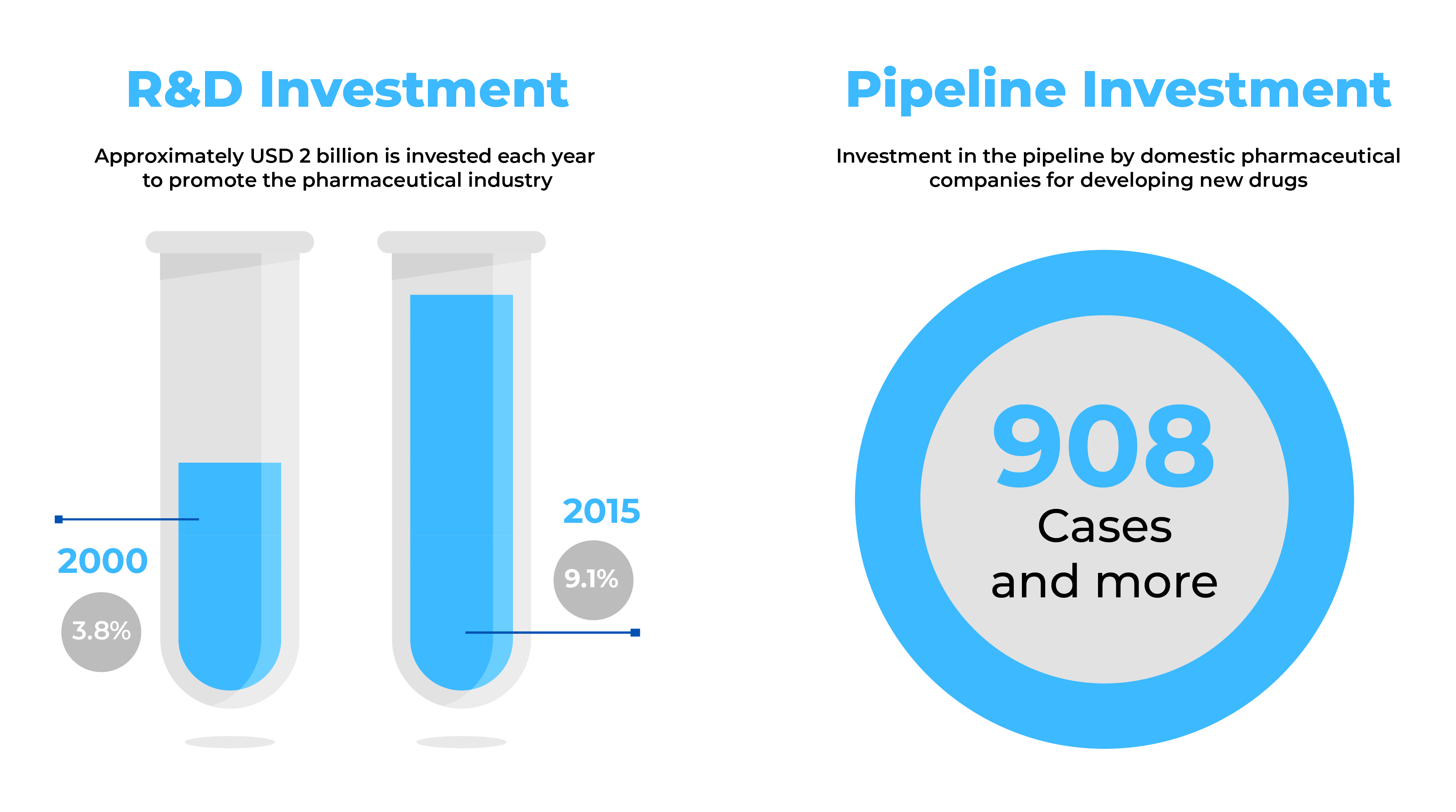
Fonte: Tendenze del settore sanitario - settembre 2014 e dati globali (2017).
I processi NDA/BLA in Corea del Sud offrono vantaggi come un processo di approvazione più rapido, regolamenti e requisiti chiari, l'incorporazione di Real World Evidence (RWE) ed esenzioni per i farmaci orfani. Tuttavia, il processo NDA/BLA in Corea del Sud può essere complesso e richiedere molto tempo. Il processo di presentazione di una New Drug Application (NDA) o di una Biologics License Application (BLA) in Corea del Sud comporta diversi passaggi.
Ecco una panoramica del processo:
- Test preclinici: Prima di poter essere valutato sull'uomo, un farmaco deve essere testato sugli animali per garantirne la sicurezza e l'efficacia. In genere, questi test vengono effettuati sugli animali.
- Sperimentazioni cliniche: Dopo il completamento della ricerca preclinica, il farmaco passa alla sperimentazione clinica sull'uomo. Questi studi sono suddivisi in tre (03) fasi, ciascuna con un numero maggiore di partecipanti.
- Presentazione NDA/BLA: Dopo il completamento degli studi clinici, lo sponsor può presentare una NDA o una BLA al Ministero della Sicurezza Alimentare e Farmaceutica (MFDS) della Corea del Sud. Tutti i cinque moduli del Documento Tecnico Comune elettronico (eCTD), che coprono i dati non clinici, clinici e di Chimica, Fabbricazione e Controlli (CMC), devono essere inclusi nella domanda.
- Approvazione: Se il MFDS determina che il medicinale è sicuro ed efficace, la NDA/BLA sarà approvata. Il medicinale può essere pubblicizzato e venduto in Corea del Sud una volta approvato.
Non risponde ancora a tutte le vostre domande?
Lasciamo che siano gli esperti a chiarire.
Per ottenere una prospettiva dettagliata sui processi NDA/BLA in Corea del Sud, Freyr ha programmato un webinar gratuito con i nostri esperti dalla Corea del Sud. Unisciti a noi per la “Panoramica del processo NDA/BLA in Corea del Sud”, in programma il 29 novembre 2023, alle 11:30 AM IST (ROW) e alle 10:00 AM EST | 3:00 PM GMT | 4:00 PM CET (Americhe ed EUA). Registrati ora! Rimanete al sicuro. Rimanete informati.
Per le regioni AMR e UE
10:00 EST | 15:00 GMT | 16:00 CET
Per la Regione RoW
11:30 TSI









