
Dopo quasi due decenni dall'emissione della prima bozza di guida, la Food and Drug Administration degli Stati Uniti (FDA US) ha finalizzato la guida sulla Farmacocinetica di popolazione (PK) nel febbraio 2022. L'ultima bozza spiega l'applicazione della PK di popolazione nello sviluppo dei farmaci e le raccomandazioni sull'individualizzazione terapeutica. La guida si applica alle domande di Investigational New Drug (IND), New Drug Applications (NDA), Biologics License Applications (BLA) e Abbreviated New Drug Applications (ANDA).
I dati dell'analisi PK di popolazione devono essere inclusi dagli sponsor/produttori di farmaci nelle domande di commercializzazione per semplificare le attività post-commercializzazione. Possono anche essere cruciali nel rispondere a domande normative da parte delle Autorità Sanitarie (HA).
Comprendere la popolazione PK
Lo studio della variabilità delle concentrazioni dei farmaci all'interno di una popolazione di pazienti che riceve dosi clinicamente rilevanti di un farmaco specifico è definito PK di popolazione. Ha lo scopo di identificare e quantificare le fonti di variabilità utili per la produzione e la raccomandazione delle dosi di tali farmaci.
Per comprendere l'intero processo della popolazione PK si può fare riferimento alla seguente illustrazione:
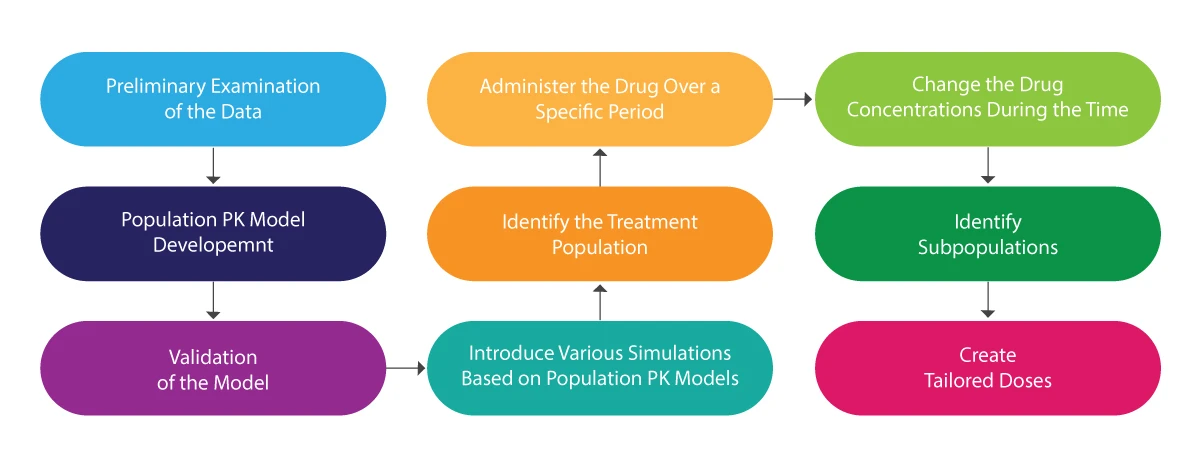
Analisi della popolazione PK - Come può essere utile?
- Aiuta a progettare regimi di dosaggio personalizzati.
- Fornisce una stima affidabile della covariata (una variabile la cui variazione può essere prevista in una ricerca/studio e può essere utilizzata per prevedere l'esito di tale studio).
- Considera fattori come la demografia, l'ambiente, la biologia, i farmaci concomitanti (altri farmaci che i pazienti assumono durante lo studio) e la concentrazione del farmaco.
- Utile per progettare studi clinici più sicuri e qualitativi, anche in ambito pediatrico.
- Ottenere la matrice di esposizione per eseguire l'analisi esposizione-risposta.
Una panoramica della guida finale della FDA US sulla farmacocinetica di popolazione (PK)
La bozza finale offre una panoramica dell'attuale posizione FDAsui dati derivanti dall'analisi farmacocinetica della popolazione e dalla presentazione dei modelli, al fine di facilitare le decisioni normative. Di seguito è riportata una breve sintesi della bozza:
Etichettatura - Fornisce raccomandazioni sull'incorporazione delle informazioni utili derivanti dall'analisi in questione nell'etichettatura. I risultati devono essere presentati nella sezione "Farmacologia clinica" e devono essere riassunti in altre sezioni dell'etichettatura, come richiesto.
Contenuto - Sono stati inoltre dettagliati il contenuto e il formato pertinente da seguire per la presentazione dei rapporti PK di popolazione alla FDA.
Processo decisionale normativo - I rapporti PK di popolazione utili per prendere decisioni normative devono essere inclusi nel modulo 5 del documento tecnico comune elettronico (eCTD).
Andare avanti
Gli sponsor che necessitano di consulenza sull'uso dell'analisi farmacocinetica di popolazione nel loro processo di sviluppo dei farmaci o per rispondere a domande di natura normativa sono stati invitati a farlo durante i loro importanti incontri con l'Agenzia. Inoltre, è fondamentale garantire buone prestazioni del modello per ottenere risultati accurati. Ciò può essere ottenuto utilizzando dati farmacocinetici sufficienti sulla popolazione di pazienti specifica e sulle sottopopolazioni rilevanti.
Può essere difficile per i produttori/sponsor di farmaci presentare rapporti PK di popolazione accurati nel formato eCTD e seguire le normative sull'etichettatura per la conformità. Contattate un esperto normativo come Freyr, che può assistervi con le vostre presentazioni e le attività di etichettatura normativa.









