
Il protocollo di convalida è definito come un piano documentato per testare un dispositivo medico al fine di confermare che il processo di produzione utilizzato per realizzare il prodotto soddisfa i requisiti specifici dell'utente, tecnici e normativi. Ciò include una revisione delle variabili di processo e delle limitazioni operative e l'analisi dei risultati dei test in condizioni di utilizzo effettivo.
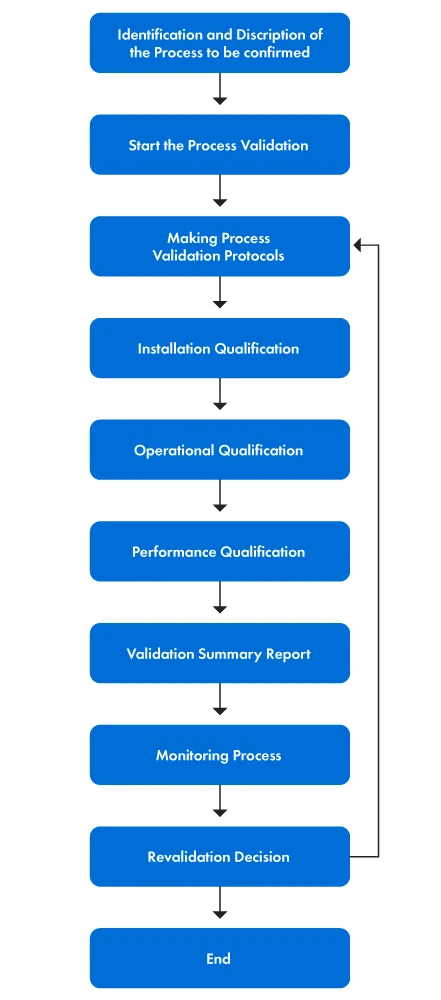
Il processo di validazione comporta diverse azioni concrete. Le fasi sono illustrate di seguito:
- In primo luogo, viene formato il team di validazione e a ciascun membro vengono assegnati ruoli e responsabilità specifici. Lo scopo della convalida del processo è fornire una chiara dichiarazione degli obiettivi della convalida e definire l'ambito delle attività di convalida, specificando gli aspetti del dispositivo medico da convalidare. Il team comprende quindi i principi alla base del processo per identificare i parametri specifici e i risultati desiderati.
- In secondo luogo, vengono stabiliti i criteri di valutazione e di accettazione, insieme alla selezione di metodi di prova, strumenti e tecniche di analisi statistica appropriati. In seguito, si redigono i protocolli di convalida del processo e si attuano la Qualificazione dell'installazione (IQ), la Qualificazione operativa (OQ) e la Qualificazione delle prestazioni (PQ).
- Infine, vengono stabiliti controlli e misure di monitoraggio del processo in corso per garantire la convalida continua del processo. Se necessario, si procede alla riconvalida per mantenere l'accuratezza e l'efficacia del processo di convalida.
La Figura 1 fornisce una rappresentazione passo-passo del processo di convalida.
Figura 1: Le fasi del processo di convalida
PVP
A causa dell'ampia gamma di volumi di produzione e di complessità produttive, esistono numerosi approcci per condurre la convalida dei processi. Tuttavia, le normativeUSFDAFood and Drug Administration) e ISO 13485 forniscono suggerimenti limitati su metodi specifici. Tuttavia, una fonte ampiamente riconosciuta e autorevole per la convalida dei processi dei dispositivi medici è un documento guida della Global Harmonization Task Force (GHTF), ora denominata International Medical Device Regulators Forum (IMDRF), pubblicato nel 2004. Rimane il riferimento principale anche sul sito ufficiale dell'USFDA.
Secondo il documento guida, viene formato un team di convalida per creare un piano dettagliato di convalida del processo (PVP). I protocolli di convalida del processo includono uno schema dettagliato su come implementare IQ, OQ, PQ e riconvalida. Il PVP deve contenere i seguenti elementi:
- Definizione del dispositivo e determinazione dell'approccio di validazione.
- Identificare gli elementi che richiedono la convalida.
- Svolgimento delle attività nel sito designato.
- Delineare l'ambito della documentazione.
- Creare un calendario per le attività di convalida.
- Sviluppo di un programma generale.
- Mantenere un elenco completo e i riferimenti alle convalide interne ed esterne eseguite.
Il protocollo di convalida viene scritto prima di condurre le attività di convalida. Deve essere preparato dal team di convalida e approvato dal reparto interessato. Lo scopo di un protocollo di convalida è quello di definire gli script di test da seguire per garantire che i processi e le apparecchiature siano pronti a produrre dispositivi medici sicuri ed efficaci.
Il protocollo di convalida comprende un rapporto analitico contenente informazioni, analisi, spiegazioni e raccomandazioni. Questi documenti vengono ulteriormente esaminati per garantire che siano soddisfatti i seguenti due (02) criteri:
- Rispetto degli standard normativi.
- Tutti i registri e i dati generati vengono esaminati per verificarne i risultati, l'adeguatezza e la completezza.
La Figura 2 rappresenta il PVP e i vari processi coinvolti.
Figura 2: Il PVP e i suoi requisiti
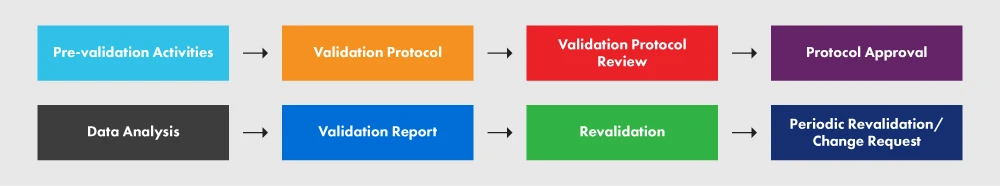
Un protocollo adeguatamente redatto fornisce chiare linee guida, politiche e procedure da rispettare durante la validazione del processo. Comprende aspetti quali strutture, attrezzature, metodi e formazione. Il protocollo specifica gli input e i limiti del processo, nonché le fasi essenziali per il successo del progetto di validazione del processo. Sebbene il seguente schema non comprenda tutti i singoli elementi richiesti dal protocollo, fornisce una panoramica del livello di dettaglio richiesto. Si consiglia vivamente di seguire il documento guida per una migliore comprensione del processo.
- Pagina del titolo
- Prodotti da coprire
- Apparecchiatura/processo da convalidare
- Generale
- Obiettivi
- Documenti di riferimento
- Piano di convalida
- QI
- OQ
- PQ
- Apparecchiature di misura/test e calibrazione
- Manutenzione delle apparecchiature
- Riconvalida
- Pagina di approvazione/firma del team di convalida
La gestione delle operazioni svolge un ruolo cruciale nel mantenimento di prestazioni ottimali, monitorando le misure chiave, rivedendo i metodi e le procedure di lavoro e intervenendo tempestivamente in caso di problemi. In caso di problemi, potrebbe essere necessario riconvalidare un processo in modo parziale o addirittura completo. Secondo la sezione 820.75(c) della USFDA Quality System Regulation (QSR), la riconvalida del processo dovrebbe essere presa in considerazione in queste circostanze: "Quando si verificano modifiche o deviazioni del processo, il produttore deve riesaminare, valutare ed eseguire la riconvalida come appropriato. Queste attività devono essere documentate".
Tra i possibili fattori scatenanti la riconvalida del processo vi sono le modifiche alle specifiche, ai metodi, alle procedure, al software, ai progetti, ai componenti chiave, alla scalatura dei lotti, ai cambiamenti di sede, alle apparecchiature e così via. Inoltre, anche l'implementazione di azioni correttive e preventive (CAPA) può servire da innesco per la rivalidazione del processo. Le ragioni principali della riconvalida sono le seguenti:
- Modifiche apportate al processo.
- Tendenza negativa della qualità, improvviso deterioramento della qualità o aumento dei reclami dei clienti.
- Importante espansione della capacità della linea.
- Modifiche alla progettazione.
- Modifiche al confezionamento dei prodotti.
- Trasferimento di un processo a un'altra struttura.
- Modifiche al processo di candidatura.
Per saperne di più sui protocolli di convalida e sulla loro importanza nel campo della produzione di dispositivi medici, us Rimanete informati! Rimanete conformi!









