
Il software per dispositivi medici in Corea del Sud viene utilizzato per diagnosticare, trattare e monitorare i pazienti nel moderno sistema sanitario. Comprende sia il software integrato nei dispositivi medici sia il software indipendente che può essere utilizzato su PC, dispositivi mobili e servizi web. Il Ministero della sicurezza alimentare e dei farmaci (MFDS) della Corea del Sud è responsabile della regolamentazione dei software per dispositivi medici e della loro sicurezza ed efficacia. Il 5 luglio 2023, l'MFDS ha stabilito i criteri per l'approvazione e l'ispezione dei software per dispositivi medici; questi regolamenti forniscono una struttura che i richiedenti civili possono seguire quando presentano un software per l'approvazione o la revisione.
Le normative trattano una serie di argomenti, tra cui l'ambito di applicazione, i requisiti relativi alla documentazione tecnica e le relazioni di verifica della conformità. Oltre alle linee guida MFDS, esistono standard e linee guida internazionali applicabili al software per dispositivi medici, come lo standard IEC 62304 della Commissione Elettrotecnica Internazionale (IEC) relativo ai processi del ciclo di vita del software e le linee guida della Food and Drug Administration (FDAUS sulle applicazioni mediche mobili.
Piano di sviluppo del software e analisi dei requisiti
- Il Piano di sviluppo del software delinea l'approccio generale allo sviluppo del software, comprese le specifiche, i metodi e gli strumenti di sviluppo. Inoltre, copre la verifica, la gestione del rischio dei dispositivi medici, la gestione della configurazione e la documentazione.
- L'analisi dei requisiti stabilisce i requisiti del software per dispositivi medici, comprese le misure di controllo del rischio e i metodi di verifica. Pianificando e analizzando attentamente il processo di sviluppo del software, gli sviluppatori possono garantire che il software risultante soddisfi i necessari standard di sicurezza ed efficacia.
- Il rapporto di verifica della conformità del software include una descrizione del piano di sviluppo del software, il numero di controllo del documento del produttore e una panoramica dell'analisi dei requisiti. Rispettando queste linee guida, il software per dispositivi medici può essere sviluppato con fiducia, sapendo che è stato sottoposto a test rigorosi e che soddisfa i necessari standard di sicurezza ed efficacia.
Verifica e convalida del software per dispositivi medici
- La verifica del software per dispositivi medici assicura che il software soddisfi i requisiti specificati.
- La convalida del software per dispositivi medici garantisce che il software soddisfi le esigenze dell'utente e l'uso previsto.
- Il rapporto di verifica e convalida del software per dispositivi medici descrive il processo di verifica e convalida, includendo il nome del prodotto, la revisione e i nomi delle persone who esaminato e approvato il rapporto. Il rapporto può variare a seconda delle caratteristiche del software, ma deve includere una descrizione del software, i metodi di verifica e convalida utilizzati e i risultati dei test.
Ambiente operativo e software di provenienza sconosciuta (SOUP)
- Se il software dipende da un hardware specifico, come nel caso del software incorporato, il documento tecnico deve descrivere le specifiche dell'hardware.
- Tuttavia, se il software è autonomo e sviluppato per funzionare su hardware generico, l'ambiente operativo deve essere descritto nel materiale grezzo. Questo include le specifiche minime raccomandate, come Microsoft Windows 10 o superiore.
- Inoltre, se il software del dispositivo medico include software commerciale di provenienza sconosciuta (SOUP), è necessario creare un ambiente operativo per garantire il corretto funzionamento. Descrivendo accuratamente l'ambiente operativo e affrontando qualsiasi SOUP, gli sviluppatori possono garantire che il loro software per dispositivi medici sia sicuro ed efficace per l'uso previsto.
Requisiti di gestione del rischio e documentazione dei dispositivi medici
- Il processo di gestione del rischio software as a medical device comprende l'identificazione di situazioni pericolose, la definizione di misure di controllo del rischio, la verifica di tali misure e la gestione delle modifiche al software.
- Il documento MFDS-RM sulla gestione del rischio software fornisce informazioni sulla gestione del rischio software.
- Inoltre, i requisiti di documentazione sono essenziali per garantire che il software soddisfi i necessari standard di sicurezza ed efficacia.
- Il piano di sviluppo del software, l'analisi dei requisiti del software per dispositivi medici e i rapporti di verifica e convalida del software devono essere inclusi nella documentazione.
- Il Rapporto di verifica della conformità del software illustra i requisiti di documentazione; include anche una descrizione dei documenti applicabili e il numero di controllo del documento del produttore.
Figura 1: Processo di gestione del rischio dei dispositivi medici
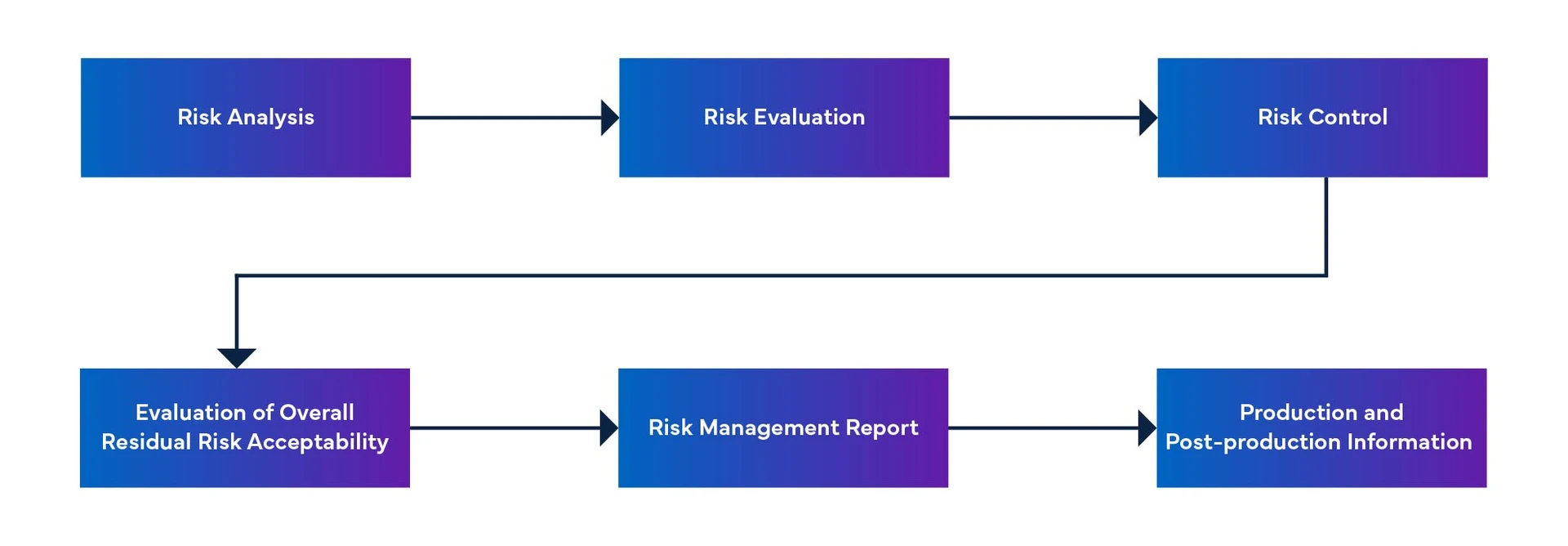
Anomalie non risolte e azioni correttive per il software SaMD
- Il documento MFDS-PR (Risoluzione dei problemi software) delinea il processo di risoluzione dei problemi software, che comprende la segnalazione, l'analisi, l'implementazione e la verifica dei problemi.
- Il documento include anche un elenco di problemi, bug, difetti e anomalie non risolti, nonché una valutazione del rischio residuo per il sistema software.
- Le azioni correttive intraprese per risolvere questi problemi devono essere documentate nel piano di manutenzione del software, stabilito in base al processo di manutenzione del software.
- Il documento di manutenzione MFDS fornisce informazioni su SaMD e alla risoluzione dei problemi.
Requisiti di revisione e presentazione dei documenti tecnici per il software SaMD
I principali documenti di revisione durante il processo di revisione sono i dati sulle prestazioni, il rapporto di conferma della conformità e i dati di verifica e convalida del software per dispositivi medici, la specifica di progettazione del software (SDS), la dichiarazione dei requisiti del software per dispositivi medici (SRS) e i rapporti di verifica e convalida. È necessario presentare il rapporto di conferma della conformità e il rapporto di verifica e convalida del software per dispositivi medici.
Gestione del rischio del software per dispositivi medici
- Identificare i potenziali rischi associati al software e al suo utilizzo.
- Valutare la gravità dei rischi associati a questi pericoli.
- Implementare misure di controllo del rischio per ridurre al minimo la probabilità di danni.
- Monitoraggio e revisione dell'efficacia di queste misure di controllo del rischio.
- Documentare tutte le attività e le decisioni di gestione del rischio dei dispositivi medici.
In un sistema software, gli elementi del software sono suddivisi in parti più piccole, compresi gli elementi software dettagliati. Quando un elemento non può essere ulteriormente scomposto, viene chiamato unità. Il sistema consente la scomposizione a livello di unità, aiutando a determinare il livello di sicurezza di ciascun elemento software. Mettendo insieme questi elementi software, siamo in grado di determinare il livello di sicurezza dell'intero sistema software.
Figura 2: Disassemblaggio e integrazione del software dei dispositivi medici
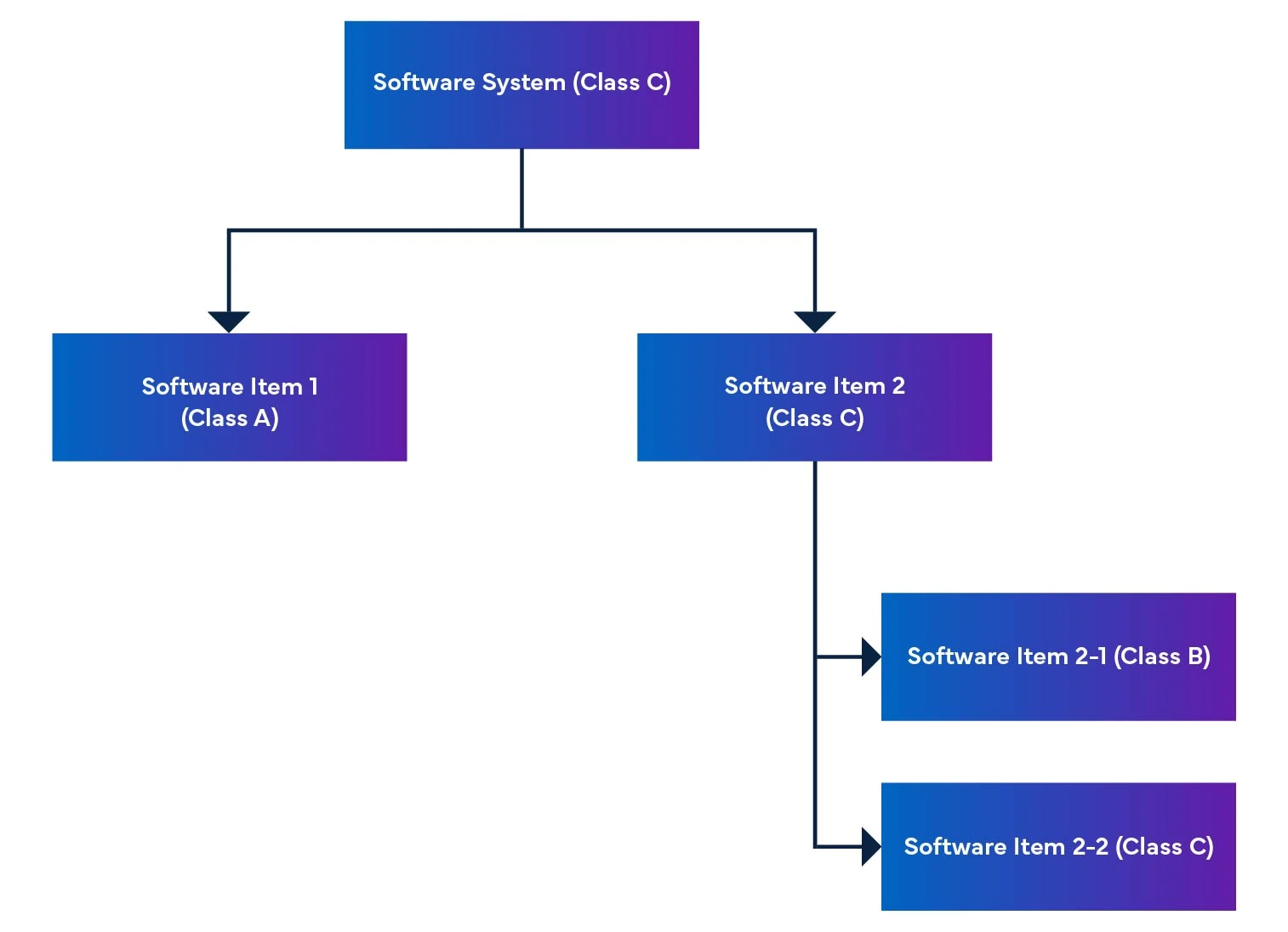
Il regolamento menziona anche la valutazione della sicurezza del software, che è una valutazione per identificare i rischi del software SaMD (vedi Tabella 1).
Tabella 1: Definizione di valutazione della sicurezza
| Valutazione | Definizione della classe di sicurezza del software per dispositivi medici |
| Classe A | Nessuna possibilità di lesioni o danni fisici. |
| Classe B | Sono probabili lesioni meno gravi (lesioni minori). |
| Classe C | Possibilità di lesioni gravi o morte. |
Gestione della configurazione del software
- Mantenere una documentazione accurata e aggiornata per tutte le versioni, le modifiche e gli aggiornamenti del software.
- Assicurare che tutta la documentazione sia adeguatamente rivista e approvata.
- Implementazione di procedure per la gestione delle modifiche alla configurazione del software.
- Documentare tutte le attività e le decisioni di gestione della configurazione del software.
Manutenzione del software
- Testando e monitorando regolarmente il software per garantire che rimanga sicuro ed efficace per l'uso previsto.
- Implementazione di procedure per la risoluzione di eventuali problemi, comprese le correzioni di bug e gli aggiornamenti del software.
- Documentare tutte le attività e le decisioni di manutenzione del software.
Risoluzione dei problemi
- Identificare la causa principale del problema.
- Implementare le azioni correttive per risolvere il problema.
- Documentare l'intero processo di risoluzione dei problemi per riferimenti futuri.
Seguendo le linee guida di cui sopra, gli sviluppatori possono assicurarsi che qualsiasi problema relativo al software dei loro dispositivi medici sia adeguatamente affrontato e documentato e che il software soddisfi i requisiti necessari per l'approvazione o l'esame.
Se siete un produttore di dispositivi medici che punta alla conformità con gli standard software della Corea del Sud, gli esperti di regolamentazione di Freyrpossono guidarvi attraverso l'intricato panorama normativo del Paese. Garantiremo che i vostri dispositivi siano in linea con le più recenti normative sui dispositivi medici della Corea del Sud, per una conformità senza soluzione di continuità. us per saperne di più!









