24 settembre 2016; con la scadenza, a solo un mese di distanza, per la conformità all'Identificatore Unico del Dispositivo (UDI) per i dispositivi di Classe II, si presume, se non è certo, che tutti i produttori di dispositivi medici siano ben attrezzati con una strategia normativa completa. Oltre ad avere una solida comprensione dei prerequisiti di governance, i produttori devono essere pronti per l'audit di conformità. Dalla convalida dei record dell'Identificatore del Dispositivo (DI) e dell'Identificatore del Prodotto (PI) fino alle presentazioni GUDID di successo, devono essere a conoscenza dei dati da presentare e delle procedure da seguire. Sia prima che dopo la presentazione, una migliore conoscenza del know-how procedurale potrebbe proteggere i produttori dalle sfide corrispondenti relative all'aggregazione dei dati, alla presentazione dei record DI e alla gestione dei rapporti sui dispositivi, al tracciamento delle conferme dell'Autorità Competente, ecc.
Per aiutare produttori affrontare meglio tali scenari, forniamo qui un'infografica di facile comprensione sulle sfide e le soluzioni relative alla conformità UDI, che potrebbe farvi risparmiare tempo nella decodifica delle complessità della conformità e consentirvi di pianificare meglio in anticipo e strutturare la roadmap.
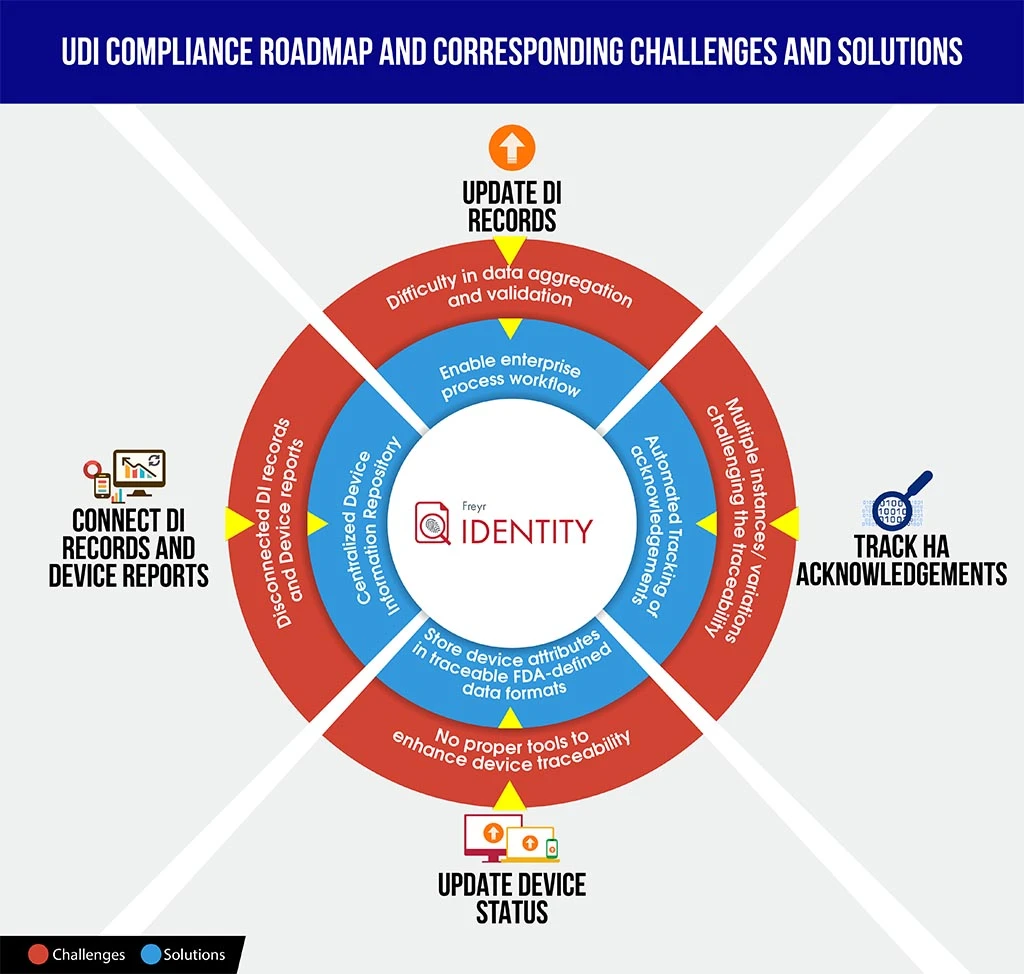
Per guidare agevolmente la vostra organizzazione attraverso questo complesso processo di conformità, Freyr il meglio di entrambi i mondi: una soluzione software UDI su richiesta e completamente configurabile,Freyr , nonché un Centro di eccellenza UDI (CoE) che offre servizi UDI personalizzabili, convenienti e di prima classe, costruiti attorno alle vostre esigenze specifiche e complesse.









