Presentazione delle domande prevista per il 24 settembre 2016.
Ora che la seconda fase della conformità UDI, per i dispositivi medici di Classe III I/LS/LS, è stata implementata, molti produttori di dispositivi, in particolare quelli di tipo Classe II, si stanno chiedendo come prepararsi al meglio per la scadenza del 24 settembre 2016 per la presentazione dei dati dei dispositivi di Classe II. Per dar loro un'indicazione, noi di Freyr abbiamo identificato alcuni dei prerequisiti che dovrebbero considerare per allineare i dispositivi di Classe II alla conformità con il mandato UDI della FDA.
La nuova normativa richiede che tutti i dispositivi medici di classe II siano etichettati e confezionati con un identificativo unico (UDI) e inseriti nel database globale di identificazione dei dispositivi (GUDID) FDA. Data la volatilità dei requisiti di conformità, unita a tempi di presentazione più brevi, la sfida per produttori di dispositivi produttori di conoscere nei minimi dettagli i processi di conformità. Allo stesso tempo, devono garantire che nessuna delle caratteristiche chiave del dispositivo venga tralasciata mentre raccolgono i dati sparsi su diversi sistemi e li riconciliamo in fogli di calcolo per creare rapporti di conformità.
Al fine di aiutare i produttori di dispositivi a navigare facilmente attraverso questo processo di conformità complesso e critico in termini di tempo, senza errori, Freyr ha compilato i seguenti prerequisiti da seguire.
Determinare la data di conformità UDI: da quando FDA emanato la sua norma definitiva, alcune delle date di conformità dei dispositivi sono state modificate e prorogate. Per pianificare meticolosamente in anticipo le strategie e i processi di conformità ed evitare modifiche affrettate dell'ultimo minuto, gli etichettatori devono determinare la data esatta di conformità.
Dispositivi di Classe II Data di conformità Requisiti di conformità 24 settembre 2016I dispositivi di classe III che devono essere etichettati con un UDI devono riportare l'UDI come marcatura permanente sul dispositivo stesso se si tratta di un dispositivo destinato a essere utilizzato più di una volta e a essere rilavorato prima di ogni utilizzo. Le etichette e le confezioni dei dispositivi medici di classe II devono recare un UDI Le date riportate sulle etichette di questi dispositivi devono essere formattate come richiesto Il software stand-alone di Classe II deve fornire il proprio UDI come richiesto. I dati dei dispositivi di classe II che devono essere etichettati con un UDI devono essere inviati al database GUDID. Per la maggior parte dei dispositivi, la data di conformità per la fabbricazione diretta è diversa da quella degli altri requisiti. In base alla categoria del prodotto, destinato al riutilizzo o alla rilavorazione, è necessario determinare la data di conformità UDI per la marcatura diretta, come indicato di seguito:
Date di conformità della marcatura diretta Categoria di dispositivi - Riutilizzati e ritrattati 24 settembre 2015 Dispositivi di supporto vitale e di sostegno vitale, indipendentemente dalla classe del dispositivo. 24 settembre 2016 Dispositivi di classe III e dispositivi autorizzati ai sensi della legge sul servizio sanitario pubblico. 24 settembre 2018 Dispositivi di classe II 24 settembre 2020 Dispositivi di classe I e dispositivi non classificati Valutare la necessità della marcatura diretta del numero UDI: Tutti i dispositivi medici che vengono utilizzati più di una volta o che devono essere ricondizionati prima di ogni utilizzo devono avere la marcatura diretta dell'UDI. Fanno eccezione i dispositivi impiantabili che non necessitano di marcatura diretta secondo la norma UDI. Anche i dispositivi monouso, anche se ritrattati, non sono tenuti a riportare un UDI permanente - 21 CFR 801.45(d)(3). Valutate quindi la necessità della marcatura diretta in base alla categoria di dispositivi medici che producete.
- Piano per la conformità globale: Esaminate i FDA che i vostri prodotti specifici devono soddisfare. Eseguite un'analisi approfondita delle lacune per individuare eventuali carenze relative ai dati o alla tecnologia, al fine di affrontare alcune delle principali sfide nel processo di rispetto delle rigide FDA . Alcune delle sfide potrebbero essere l'ottenimento delle informazioni DI o PI e la gestione di grandi volumi di dati non strutturati provenienti da fonti disparate, ecc. Invece di lavorare fino a tarda notte per riconciliare tutti i dati dei dispositivi medici all'ultimo minuto, pianificate in anticipo una conformità completa attraverso sistemi e strumenti convalidati che supportano l'integrazione, la qualità e la gestione dei dati.
![]()
Ottenere il numero DI e l'iscrizione all'Agenzia: L'UDI è composto dall'identificatore del dispositivo (DI - numero univoco basato sulla versione o sul modello del dispositivo) e dall'identificatore del prodotto (PI - include il numero di lotto, il numero di serie o la data di scadenza). La parte DI dell'UDI fungerà da chiave primaria per cercare informazioni sul dispositivo nel GUDID. Per assegnare il DI, la FDA accreditato tre agenzie di emissione: GS1, HIBCC e ICCBBA. In questo scenario, gli etichettatori devono ottenere l'adesione a una delle agenzie per ottenere il numero DI che deve essere inserito nel GUDID FDA.
![]()
Identificatore Attributi Agenzie di emissione UDI DI (Device Identifier - Static Data)
Richiesto per essere sincronizzato con GUDIDNumero unico di
Produttore
Marca del dispositivo
Modello di dispositivo
GSI
HIBCC
ICCBBAPI (Product Identifier - Dynamic Data)
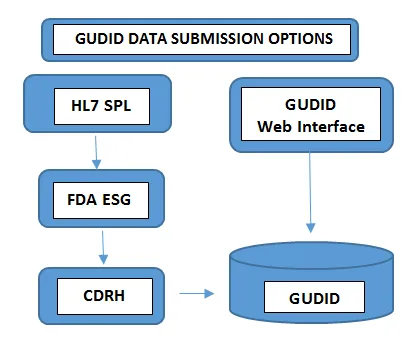
Richiesto su tutti i livelli di imballaggio.Numero di lotto, numero di serie, data di fabbricazione Data di scadenza, - Invio dei dati: Le modalità di invio dei dati a GUDID variano in base al volume dei portafogli di prodotti gestiti. I produttori di dispositivi con un numero minimo di dispositivi scelgono di inviare le informazioni UDI manualmente tramite l'interfaccia web gratuita GUDID della FDA. In questo caso, è possibile inviare un solo record DI alla volta tramite un'interfaccia web GUDID sicura. Nell'altro caso, i produttori con un numero maggiore di portafogli di prodotti scelgono l'opzione di invio HL7 SPL per raccogliere i dati elettronicamente e convertire i dati consolidati in formato SPL prima di inviarli all'Electronic Submission Gateway (ESG) della FDA, utilizzando il numero DUNS. Si prega di notare che l'account GUDID non è basato sul tipo di invio. L'account serve a identificare l'etichettatore per consentire l'invio dei dati del dispositivo tramite entrambe le opzioni.
![]()
- Creazione di un account GUDID: un'azienda produttrice di etichette/dispositivi necessita di uno o più account GUDID in base al numero di ruoli da assegnare; per citarne alcuni, coordinatore GUDID, utente per l'inserimento dei dati, ecc. Tuttavia, per autorizzare ciascun ruolo all'inserimento dei dati, il produttore deve ottenere l'approvazione della FDA della creazione dell'account. Il processo di creazione di un account GUDID appropriato prevede l'invio di una richiesta via e-mail alla FDA il richiedente, ovvero voi, riceverà un documento di richiesta di account da compilare. Una volta rispedito il documento compilato alla FDA e-mail, l'agenzia esaminerà il modulo e invierà un'e-mail con le informazioni di accesso all'account GUDID.
L'implementazione dell'UDI è un processo complesso e dispendioso in termini di tempo. Durante il corso, pur soddisfacendo i requisiti UDI FDA, produttori di dispositivi medici produttori molte sfide relative alla gestione, all'integrazione e alla presentazione dei dati. Con la scadenza per la conformità dei dispositivi di Classe II a solo un anno di distanza, Freyr raccomanda alle aziende di iniziare a lavorare fin da ora per raggiungerla.
Per guidare la vostra organizzazione attraverso questo complesso processo di conformità, Freyr il meglio di entrambi i mondi: una soluzione software UDI su richiesta e completamente configurabile,Freyr , nonché un Centro di eccellenza (CoE) che offreservizi UDIpersonalizzabili, convenienti e di prima classe, costruiti attorno alle vostre esigenze specifiche e complesse.