Un “dispositivo di riferimento” è un dispositivo medico che è stato già approvato dalla Food and Drug Administration degli US (US FDA) ed è già sul mercato, che serve come punto di riferimento per i nuovi dispositivi medici che richiedono l'approvazione attraverso il percorso di autorizzazione 510(k) della FDA.
È necessario dimostrare che il dispositivo in questione è sicuro ed efficace almeno quanto il dispositivo precedente in termini di uso previsto e caratteristiche tecnologiche. Questo confronto è noto come determinazione dell'"equivalenza sostanziale".
Non è necessario che un nuovo dispositivo sia identico al dispositivo precedente perché sia sostanzialmente equivalente a quest'ultimo.
Come identificare un dispositivo predicato?
Il database FDAfornisce un codice prodotto di tre lettere per ogni classificazione di dispositivo. Il database FDA (k) contiene informazioni su tutti i dispositivi approvati attraverso ilprocesso 510(k). Una volta ottenuto il codice prodotto di tre lettere, è possibile ottenere un elenco di tutti i prodotti, tutte le aziende e il nome commerciale di tutti i concorrenti o potenziali concorrenti che si desidera esaminare. È quindi possibile effettuare un'analisi approfondita e un confronto per restringere il campo dei dispositivi di riferimento.
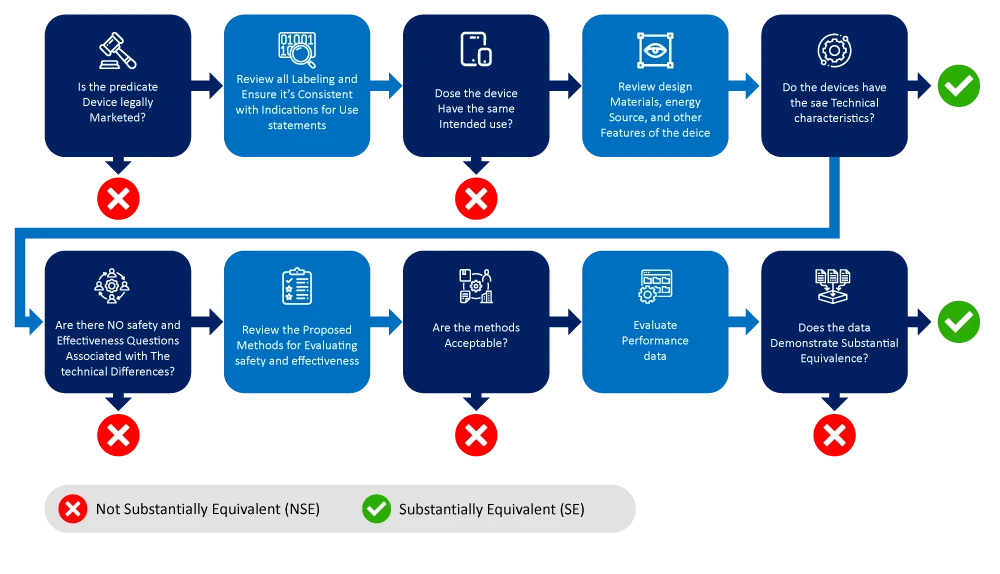
Di seguito è riportato un diagramma di flusso che illustra il processo di identificazione e restringimento del campo dei dispositivi di riferimento.
Fattori da considerare per la determinazione del/i dispositivo/i predicato/i
- Uso previsto: La destinazione d'uso del dispositivo precedente deve essere simile a quella del nuovo dispositivo. Ad esempio, se il nuovo dispositivo è destinato a essere utilizzato per il monitoraggio cardiaco, anche il dispositivo predicato deve essere un dispositivo per il monitoraggio cardiaco.
- Caratteristiche tecnologiche: Il dispositivo precedente deve essere identico al nuovo dispositivo in termini di caratteristiche tecnologiche. Ad esempio, il design, i materiali utilizzati e il metodo di funzionamento devono essere simili.
- Biocompatibilità: La valutazione della biocompatibilità di un dispositivo o di un componente medico non deve limitarsi alle materie prime utilizzate nel dispositivo e nel processo di produzione, ma deve prendere in considerazione anche altre sostanze chimiche. Questo fattore, tuttavia, non si applica agli IVD.
- Tecnologia più recente: Il dispositivo in questione non deve essere datato e deve rappresentare la tecnologia medica più recente.
Il dispositivo di riferimento è un fattore chiave per determinare se un nuovo dispositivo medico può essere immesso sul mercato attraverso il percorso 510(k). La scelta del dispositivo di riferimento sbagliato può comportare un processo di approvazione regolamentare più costoso e lungo, mentre la scelta del dispositivo di riferimento giusto può contribuire a ridurre i costi e i tempi necessari per immettere sul mercato un nuovo dispositivo medico. Se il dispositivo di riferimento non è adatto, potrebbero verificarsi ritardi e spese aggiuntive.
Per assistenza con la procedura di presentazione della domanda 510(k) relativa al vostro dispositivo medico, fissate un appuntamento telefonico con gli esperti Freyr , che vi aiuteranno a districarvi tra le varie procedure. Rimanete informati. Rimanete conformi.









