Nel corso degli anni, con i progressi del software e della digitalizzazione, si è verificato un cambiamento sismico nel modo in cui i dispositivi medici vengono amministrati e forniti. L'integrazione del software con i dispositivi medici è aumentata rapidamente e ha portato a incredibili progressi nella fornitura di soluzioni sanitarie in vari ambiti, come la diagnosi, la prevenzione delle malattie e il trattamento di lesioni o malattie.
Tuttavia, l'effetto del software sulla sicurezza e sulle prestazioni dei dispositivi medici è stato dubbio, in particolare quando il dispositivo stesso è un prodotto costituito esclusivamente da software. Di conseguenza, le normative relative al software dei dispositivi medici vengono costantemente riviste per determinare la considerazione del software as a medical device SaMD). Recentemente, il comitato consultivo della European Commission Medical Device Coordination Group (MDCG) si è concentrato sul miglioramento delle normative relative al software dei dispositivi medici e ha pubblicato una guida che descrive l'approccio da applicare per determinare se un software sia o meno un dispositivo medico. Cosa prevede la guida? us .
L'ambito di applicazione della Guida
Le linee guida MDCG riguardano sia il software per dispositivi medici che il software per dispositivi medici diagnostici in vitro (IVD). Secondo il documento, un software per dispositivi medici (MDSW) è definito come un software destinato ad essere utilizzato da solo o in combinazione, per uno scopo specificato nella definizione di "dispositivo medico" nel regolamento sui dispositivi medici 2017/745 (MDR) o nel regolamento sui dispositivi medico-diagnostici in vitro 2017/746 (IVDR). Esso delinea i criteri da applicare per determinare se un software soggetto a revisione sia o meno un dispositivo medico e intende fornire ulteriori chiarimenti e raccomandazioni sul MDSW per produttori di dispositivi medici produttori altre parti interessate.
In primo luogo, la guida definisce i termini più importanti utilizzati nel contesto del MDSW, che comprendono:
Destinazione d'uso: l'uso a cui è destinato un dispositivo secondo i dati forniti dal produttore sull'etichetta, nelle istruzioni per l'uso, nel materiale promozionale o di vendita o nelle dichiarazioni e come specificato dal produttore nella valutazione clinica.
Accessorio: Un articolo che, pur non essendo esso stesso un dispositivo medico, è destinato dal suo fabbricante a essere utilizzato insieme a uno o più dispositivi medici per consentire specificamente l'uso del dispositivo medico in conformità con la sua destinazione d'uso o per assistere la funzionalità del dispositivo medico in modo specifico e diretto rispetto alla sua destinazione d'uso. Inoltre, l'MDCG menziona che l'accessorio software può guidare o influenzare l'uso di un dispositivo medico e che le istruzioni per l'uso e l'altra documentazione fornita dal produttore devono contenere dettagli sulle modalità di selezione del software e degli accessori appropriati.
Software: è un insieme di istruzioni che elabora i dati di input e crea dati di output.
Determinazione del software per dispositivi medici
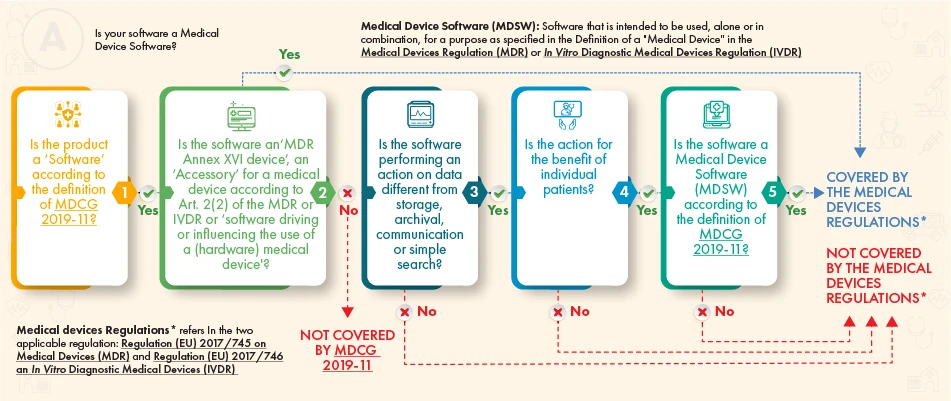
Secondo il diagramma di flusso di cui sopra, il software in questione dovrebbe essere soggetto a regolamentazione se soddisfa i seguenti criteri:
- La definizione di un dispositivo medico, di un suo accessorio o di un comando per il funzionamento del dispositivo medico, oppure
- Esegue un'elaborazione aggiuntiva dei dati (non solo la memorizzazione o la comunicazione) e la sua azione crea benefici per i pazienti e soddisfa la definizione di software per dispositivi medici in conformità alla guida MDCG.
Determinazione del software per i dispositivi medici diagnostici in vitro
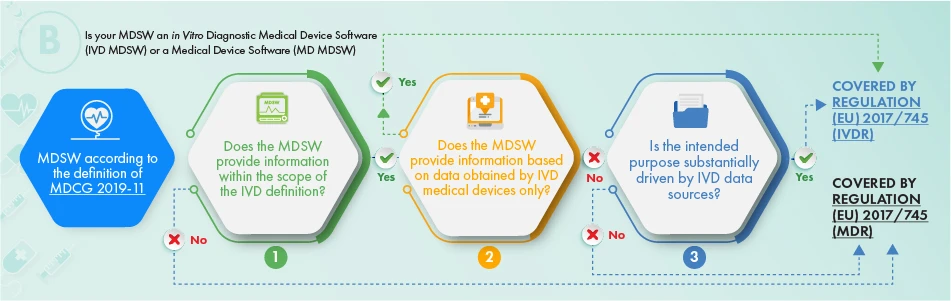
Il diagramma di flusso sopra riportato descrive l'approccio da applicare, per quanto riguarda i prodotti destinati a scopi diagnostici in vitro. Per stabilire se il software in questione debba essere soggetto a regolamentazione, occorre considerare i seguenti criteri:
- La definizione di un dispositivo medico, di un suo accessorio o di un comando per il funzionamento del dispositivo medico, oppure
- Fornisce le informazioni normalmente fornite dai dispositivi medico-diagnostici in vitro e solo le informazioni raccolte da un dispositivo medico-diagnostico in vitro, oppure
- Lo scopo del software è legato alle questioni IVDR.
Secondo la guida MDCG, il tipo di interconnessione tra il software del dispositivo medico e il dispositivo non influisce sulla qualificazione del software come dispositivo ai sensi della MDR e della IVDR. Il software di un dispositivo medico può esistere come prodotto autonomo o essere incorporato in un dispositivo hardware e chiarisce i seguenti requisiti normativi:
- Considerando la sua qualificazione e classificazione, un prodotto software per dispositivi medici stand-alone deve essere sottoposto a tutte le procedure di regolamentazione in conformità con la legislazione applicabile.
- Un software per dispositivi medici che sia componente o parte integrante di un dispositivo medico hardware potrebbe essere immesso sul mercato con procedura semplificata. Sarebbe soggetto a revisione non separatamente, ma durante la valutazione generale del dispositivo medico hardware stesso.
In sintesi, le linee guida MDCG coprono gli aspetti fondamentali relativi alla classificazione dei software per dispositivi medici e alla determinazione dei requisiti normativi da applicare. produttori di dispositivi medici, gli sviluppatori di software e le altre parti interessate devono seguire e attuare le raccomandazioni MDCG per garantire la conformità. Per ulteriori approfondimenti sulla classificazione del vostro software come dispositivo medico, consultate un esperto in materia di normative. Rimanete informati. Rimanete conformi.









