
Qual è il ruolo della sicurezza informatica nei dispositivi medici?
Il processo di autorizzazione 510(k)è un percorso normativo utilizzato dalla Food and Drug Administration (FDAUS StatiUS per valutare e autorizzare la distribuzione commerciale dei dispositivi medici. Il processo mira a garantire che i dispositivi medici siano sicuri ed efficaci per l'uso da parte dei pazienti. LaFDA US FDA la sicurezza informatica come "[i]l processo di prevenzione dell'accesso non autorizzato, della modifica, dell'uso improprio o del rifiuto di utilizzo, o dell'uso non autorizzato delle informazioni archiviate, consultate o trasferite da un dispositivo medico a un destinatario esterno".
I dispositivi medici sono sempre più connessi alle reti e quindi vulnerabili alle minacce alla sicurezza informatica, come hacking, violazioni dei dati e attacchi malware. Affrontare il problema della cybersecurity nella fase di progettazione e sviluppo è fondamentale per garantire che i dispositivi medici dispongano di controlli di sicurezza adeguati. Le minacce e le vulnerabilità non possono essere eliminate e la riduzione dei rischi di cybersecurity è particolarmente impegnativa. Se la cybersecurity non viene mantenuta in modo adeguato, potrebbe portare alla compromissione della funzionalità dei dispositivi, alla perdita di dati personali o medici e alla possibilità che le minacce alla sicurezza si diffondano ad altre reti o dispositivi interconnessi.
Incidenti causati da una sicurezza informatica compromessa
Gli incidenti di cybersecurity hanno reso inoperativi dispositivi medici e reti ospedaliere, causando l'interruzione dell'erogazione dell'assistenza ai pazienti nelle strutture sanitarie negli US. Tali attacchi informatici e sfruttamenti possono anche causare danni ai pazienti a causa di rischi clinici, ad esempio, un ritardo nella diagnosi e/o nel trattamento dei pazienti.
Di seguito sono elencati i principali incidenti avvenuti nel settore sanitario che sottolineano l'importanza della sicurezza informatica per la sicurezza dei pazienti.
- Nel 2017, l'attacco ransomware WannaCry ha colpito i sistemi ospedalieri e i dispositivi medici di tutto il mondo.
- Nel 2020, un attacco ransomware a un ospedale tedesco ha evidenziato il potenziale impatto di ottantatré (83) ritardi nell'assistenza ai pazienti, in quanto l'attacco ha costretto a dirottare i pazienti verso un altro ospedale.
Considerazioni chiave sulla sicurezza informatica per l'autorizzazione 510(k)
Di seguito sono riportati i principi generali di sicurezza informatica per produttori di dispositivi medici, secondo le linee guidaFDA US specifiche per le richieste di immissione in commercio.
- Regolamento del Sistema Qualità (QSR).: I produttori dovrebbero affrontare i problemi di cybersecurity nella fase di progettazione e sviluppo del dispositivo medico, poiché ciò può portare a una mitigazione più robusta ed efficiente dei rischi per i pazienti. I produttori dovrebbero stabilire input di progettazione relativi alla cybersecurity per il loro dispositivo e un approccio alla gestione delle vulnerabilità e della cybersecurity come parte della convalida del software e dell'analisi dei rischi richiesta dal 21 CFR 820.30(g).
- Sicurezza della Progettazione: I produttori di dispositivi devono assicurarsi che i loro prodotti siano progettati tenendo conto della sicurezza del dispositivo. La US FDA valuterà l'adeguatezza della sicurezza, basandosi sulla capacità del dispositivo di fornire e implementare obiettivi di sicurezza come autenticità, autorizzazione, disponibilità, riservatezza e sicurezza, e aggiornabilità tempestiva in tutta l'architettura del sistema.
- Trasparenza: La mancanza di informazioni sulla cybersicurezza del dispositivo, ad esempio le informazioni necessarie per integrare il dispositivo nell'ambiente di utilizzo, nonché le informazioni necessarie agli utenti per mantenere la cybersicurezza durante il ciclo di vita del dispositivo, può potenzialmente comprometterne la sicurezza e l'efficacia. Per rispondere a queste preoccupazioni, è importante che gli utenti del dispositivo abbiano accesso alle informazioni relative ai controlli di sicurezza informatica, ai rischi potenziali e ad altre informazioni rilevanti.
- Documentazione per la Presentazione: La progettazione e la documentazione della cybersecurity del dispositivo dovrebbero essere proporzionate al rischio di cybersecurity del dispositivo. I produttori dovrebbero considerare il sistema più ampio in cui un dispositivo può essere utilizzato.
Figura 1: Sfide e soluzioni comuni per la sicurezza informatica 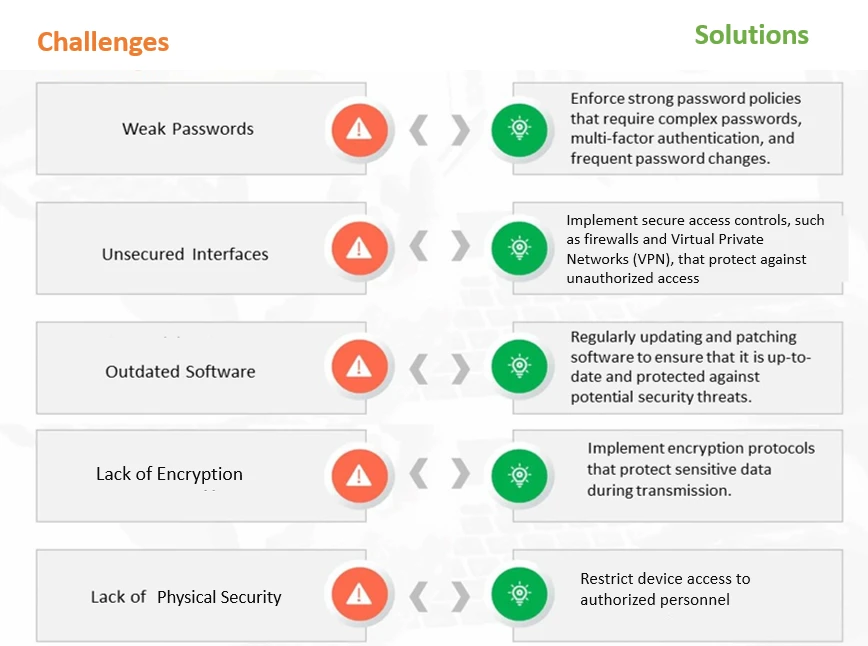
Conclusione
In sintesi, la sicurezza informatica dei dispositivi medici è fondamentale per garantire la sicurezza dei pazienti e prevenire incidenti che potrebbero compromettere l'erogazione delle cure sanitarie. Le normativeFDA US sottolineano la necessità che produttori le questioni relative alla sicurezza informatica durante la progettazione e lo sviluppo dei dispositivi medici e forniscano informazioni trasparenti sui controlli di sicurezza informatica. Il QSR, la sicurezza della progettazione, la trasparenza e la documentazione di presentazione sono considerazioni fondamentali per l'autorizzazione 510(k). È inoltre importante affrontare le sfide comuni in materia di sicurezza informatica, come le vulnerabilità dei componenti di terze parti e gli attacchi ransomware, e implementare soluzioni quali una solida analisi dei rischi e aggiornamenti software regolari.
Per sperimentare un processo di autorizzazione 510(k) conforme e senza problemi, contattate i nostri esperti di regolamentazione. Rimanete informati! Rimanete conformi!









