
Nell'ottica di una tracciabilità globale dei dispositivi, il Ministero della Sicurezza Alimentare e dei Medicinali (MFDS) della Corea del Sud ha suggerito/richiesto un nuovo requisito normativo per l'incorporazione del sistema di identificazione univoca dei dispositivi (UDI) nei dispositivi medici. La registrazione dei dispositivi medici e l'UDI sono procedure integrate e l'UDI è un prerequisito per l'introduzione dei dispositivi medici nel mercato coreano. Per garantire la sicurezza dei pazienti, nel 2016 l'MFDS ha introdotto l'Integrated Medical Device Information System (IMDIS), una piattaforma per regolare la tracciabilità dei dispositivi medici in Corea del Sud.
Secondo l'Articolo 2 della Legge sui Dispositivi Medici che specifica le normative UDI per i dispositivi medici, un sistema UDI include i numeri e i codici a barre indicati sul contenitore e sulla confezione, ecc., dei dispositivi medici in un sistema standardizzato per identificarli e gestirli in modo completo ed efficace. MFDS si aspetta che i produttori registrino le informazioni all'interno della piattaforma IMDIS. IMDIS è utilizzato per collegare elettronicamente il sistema informativo relativo ai dispositivi medici.

Fonte: Easy Medical Device
L'UDI consiste in un codice a barre leggibile dalla macchina che comprende:
- Identificatore del dispositivo: una combinazione di cifre o alfabeti generata in modo univoco per ciascun prodotto nell'UDI.
- Identificatore di prodotto - una combinazione di cifre o lettere generata dall'unità di produzione nell'UDI. Include il numero di fabbricazione (lotto, numero di serie), la data di produzione e le informazioni sulla versione del prodotto.
Tempistiche per l'incorporazione dei requisiti UDI nel confezionamento dei dispositivi medici:
Nell'ambito della revisione della legge sui dispositivi medici del 2016, è stato introdotto l'IMDIS per comprendere ed eseguire una tracciabilità sistematica dei dispositivi. Dopo il successo dell'applicazione della piattaforma IMDIS, l'incorporazione dell'UDI nelle confezioni è stata condotta in modo graduale, rendendo l'UDI obbligatorio come mostrato nella figura seguente.
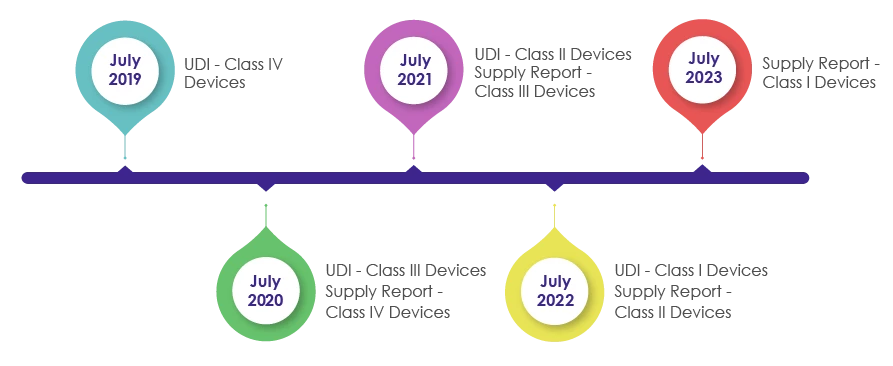
MFDS richiede ai produttori, ai venditori e ai fornitori di dispositivi medici di registrare i dati dei dispositivi forniti e di fornire le informazioni sulla fornitura (che includono Fornitore, Numero di lotto, Unità di imballaggio, Quantità, Data, Prezzo unitario per prezzo di vendita) nella segnalazione di fornitura nell'UDI.
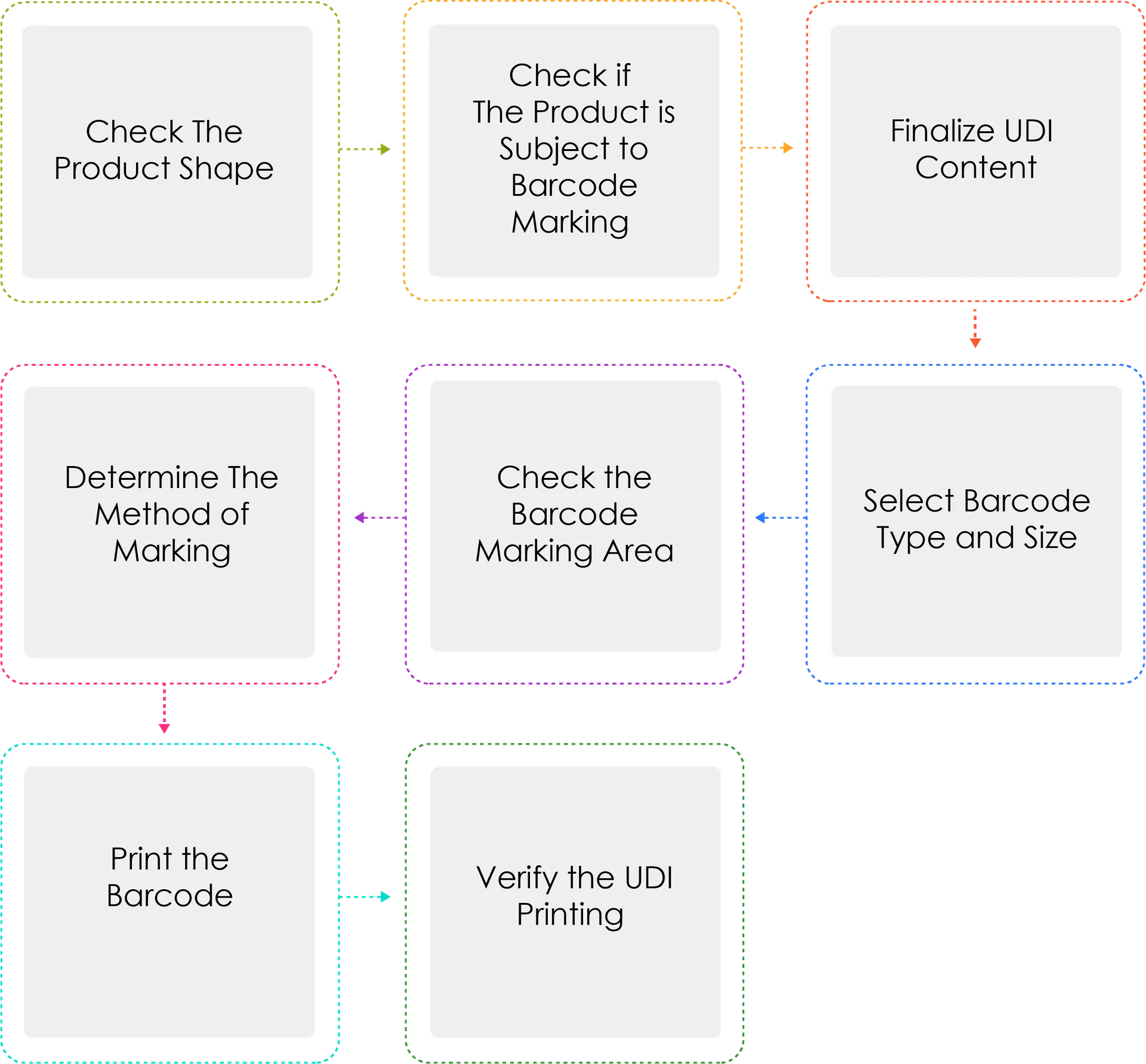
Processo di generazione di un UDI:
I produttori o gli importatori di dispositivi medici devono assegnare un UDI ai loro dispositivi per nome del modello e unità di confezionamento ai sensi dell'Articolo 3(2) prima di spedire dispositivi medici autorizzati, certificati o segnalati. Quando l'UDI è contrassegnato come codice a barre, deve essere utilizzato il sistema standard internazionale GS1. Per l'UDI-DI, deve essere utilizzato un codice Global Trade Item Number (GTIN), mentre per l'UDI-PI, devono essere utilizzati gli identificatori di applicazione GS1 (AI).
Perché Determine è il metodo di marcatura scritto tre volte?
Con l'implementazione dei requisiti di conformità agli UDI, l'MFDS è in grado di semplificare le attività pre-mercato (conformità del SGQ, valutazione degli studi clinici e approvazione generale) e le attività post-mercato (segnalazione degli errori, richiami) dei dispositivi. Il tentativo consapevole dell'MFDS di tracciare e monitorare i dispositivi garantirà la sicurezza e l'efficacia dei dispositivi nel mercato sudcoreano.
Per ulteriori informazioni sulla conformità UDI e sul processo di registrazione dei dispositivi medici in Corea del Sud, reach Freyr.









