
I dispositivi medici vengono sottoposti a una valutazione di conformità prima di essere inseriti nell'elenco ARTG, al fine di garantire che siano conformi ai principi essenziali richiesti dalla Therapeutic Goods Administration (TGA), Australia. I principi essenziali delineano fondamentalmente le caratteristiche di sicurezza e prestazione che ogni dispositivo deve soddisfare per poter essere venduto in Australia. Analogamente al processo in vigore nell'UE, la valutazione di conformità in Australia si basa sulla classe di rischio del dispositivo. Pertanto, il percorso di valutazione della conformità che deve essere seguito da qualsiasi dispositivo dipende dalla sua classificazione.
Esistono diversi standard normativi che si applicano a vari tipi di dispositivi. La conformità a uno o più standard è un requisito essenziale. L'identificazione degli standard pertinenti applicabili al dispositivo e il successivo collaudo del dispositivo per dimostrarne la conformità allo standard diventano un prerequisito.
La valutazione di conformità comporta un esame sistematico dei documenti tecnici relativi al dispositivo. La gestione dei rischi, la valutazione clinica, il processo di fabbricazione e le attività di vigilanza svolte dal fabbricante sono gli aspetti critici da valutare. I dispositivi che devono essere muniti di un certificato di valutazione di conformità TGA sono elencati nel regolamento 4.1 del Therapeutic Goods (Medical Devices) Regulations 2002. Sebbene il certificato di valutazione della conformità rilasciato dalla TGA sia un prerequisito per la commercializzazione della maggior parte dei dispositivi medici in Australia, la TGA accetta anche i certificati di valutazione della conformità rilasciati dagli organismi notificati in Europa. Inoltre, la TGA accetta anche le valutazioni di conformità dei paesi che fanno parte del MDSAP Medical Device Single Audit Program).
I requisiti di valutazione della conformità variano a seconda della categoria di rischio del dispositivo. La tabella n. 1 illustra in dettaglio il processo di valutazione della conformità basato sulla classificazione in Australia.
Processo di valutazione della conformità - Australia
Classe | Procedura di valutazione della conformità | Responsabilità del produttore |
| I | Parte 6 (Dichiarazione di conformità, che non richiede la valutazione da parte del Segretario) | Documentazione attestante la conformità ai Principi Essenziali |
| I (misurazione) e IIa (non sterile) | Parte 6 (Dichiarazione di conformità, che non richiede la valutazione da parte del Segretario) Parte 5 (Sistema di gestione della qualità del prodotto) | Documentazione attestante la conformità ai Principi Essenziali. Implementare un sistema di gestione della qualità dei prodotti per l'ispezione finale e i test per gli audit. Nota: la presentazione della Dichiarazione di conformità non è richiesta per la Classe I (non misurante e non sterile), ma deve essere disponibile su richiesta della TGA. |
| I (sterile) e IIa (sterile) | Parte 6 (Dichiarazione di conformità, che non richiede la valutazione da parte del Segretario) Parte 4 (Garanzia della qualità della produzione) | Documentazione attestante la conformità ai Principi Essenziali. Implementare un sistema di gestione della qualità che escluda l'elemento di progettazione, basato sulla norma ISO 13485. |
| IIb | Parte 1 (Garanzia di qualità totale) esclusa la clausola 1.6 (Esame della progettazione) | Implementare un sistema di gestione della qualità completo che includa progettazione, produzione, etichettatura, imballaggio e ispezione finale in base alla norma ISO 13485. Esclude il fascicolo di progettazione. |
| III e AIMD | Parte 1 (Garanzia di qualità completa) compresa la clausola 1.6 (Esame della progettazione) | Implementare un sistema di gestione della qualità completo che includa progettazione, produzione, etichettatura, imballaggio e ispezione finale in base alla norma ISO 13485. Dossier di progettazione conforme ai Principi Essenziali. |
| Sistemi o pacchetti procedurali Parte 7 | (Procedure per Dispositivi Medici Usati per uno Scopo Speciale) | Principi essenziali. Procedura di valutazione della conformità. Prove cliniche relative ai singoli componenti del sistema o della confezione. |
Tabella n. 1. Requisiti di valutazione della conformità dei dispositivi
Il normale processo di approvazione dei dispositivi medici da parte della TGA è il seguente:
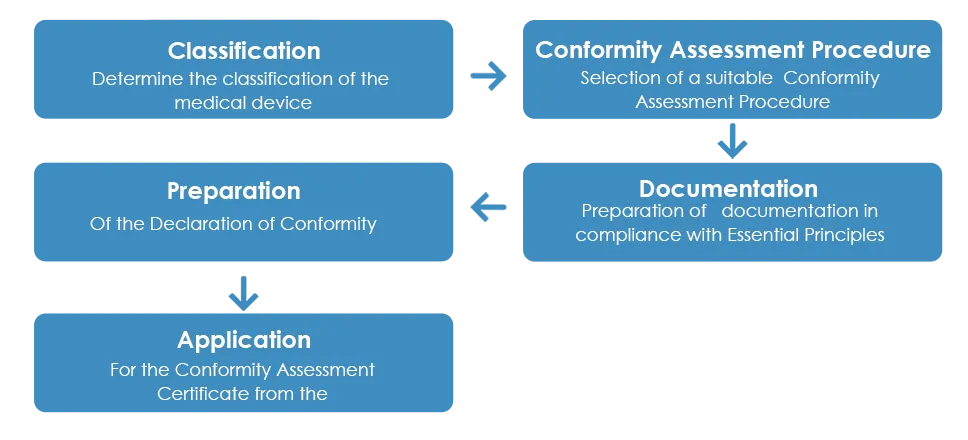
Come dettagliato sopra, una volta ricevuto il Certificato di Valutazione della Conformità dalla TGA, il fabbricante deve preparare una Dichiarazione di Conformità (DoC) dichiarando che il dispositivo medico è conforme ai principi essenziali applicabili, alle regole di classificazione e al percorso di valutazione della conformità. Tuttavia, a differenza del Certificato di Valutazione della Conformità, una DoC europea non è accettata dalla TGA.
Il mercato australiano offre un panorama promettente per produttori di dispositivi medici, a condizione che siano soddisfatti i requisiti normativi della Therapeutic Goods Administration (TGA). I requisiti di conformità e il processo di valutazione variano a seconda della classe di rischio del dispositivo e dell'IVD. Sebbene le normative sui dispositivi medici siano ben definite e trasparenti, orientarsi al loro interno è complesso e i produttori richiedere il supporto dei partner normativi per ottenere l'inserimento del dispositivo nell'elenco.
Per ottenere informazioni complete sui requisiti di valutazione della conformità, sullo sponsor australiano e sull'inserimento nell'ARTG in Australia,contattate un esperto in materia di normative. Rimanete informati. Rimanete conformi.









