
Un 510(k) o una notifica pre-commercializzazione è una presentazione fatta alla Food and Drug Administration degli Stati Uniti (US FDA) per dimostrare che il dispositivo da commercializzare è sicuro ed efficace, cioè sostanzialmente equivalente a un dispositivo legalmente commercializzato o a un dispositivo precedente. Di seguito sono elencati i tre tipi di 510(k) che un produttore di dispositivi medici può presentare:
- Tradizionale
- Abbreviato
- Speciale 510(k)
In questo blog, esamineremo i casi in cui la vostra domanda si qualificherebbe per il secondo tipo, un 510(k) abbreviato, secondo i requisiti della US FDA.
Un 510(k) abbreviato è utilizzato per dimostrare l'equivalenza sostanziale a uno standard riconosciuto, un controllo speciale o una guida utilizzando una Dichiarazione di Conformità (DoC). In una presentazione abbreviata, i produttori dimostrano l'equivalenza sostanziale a standard riconosciuti basandosi sull'uso di documenti guida o DoC, anziché su un dispositivo precedente, per facilitare la revisione della FDA. Di seguito è riportato il diagramma di flusso per determinare l'equivalenza sostanziale per una domanda di 510(k) abbreviata.
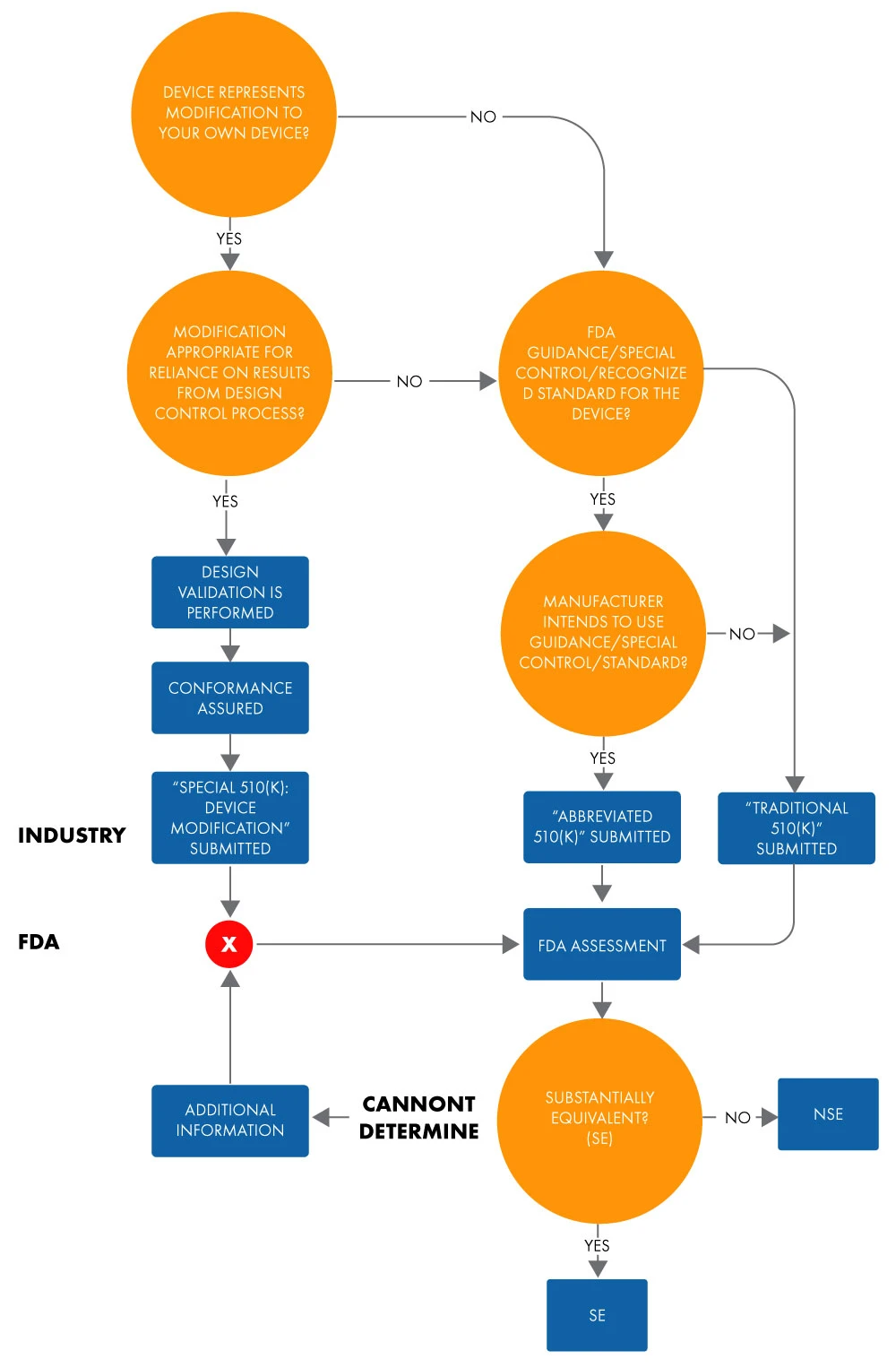
Figura 1: Intento di commercializzazione del dispositivo tramite 510(k)
Il termine "abbreviato" suggerisce che questo tipo di processo di approvazione 510(k) sia più breve. Tuttavia, ciò non è del tutto vero. Il tempo necessario è pari a quello di un'approvazione 510(k) tradizionale. Lo stesso vale per la documentazione e i costi. Inoltre, il formato della 510(k) tradizionale e di quella abbreviata, in termini di capitoli e struttura, sono simili.
Per la presentazione di una 510(k) abbreviata è necessario basarsi sugli elementi identificati nella norma 21 CFR 807.87 (presentazione di 510[k] tradizionali). Si può scegliere di presentare una 510(k) abbreviata quando la presentazione si basa sui seguenti elementi:
- DocumentiFDA : quandosi presenta una domanda abbreviata 510(k), è necessario allegare una relazione sintetica che descriva l'aderenza al documento guida pertinente e il modo in cui è stato utilizzato durante lo sviluppo e il collaudo del dispositivo.
- Dimostrazione della conformità ai controlli speciali per il tipo di dispositivo: è necessariorispettare i controlli speciali quali standard prestazionali, sorveglianza post-commercializzazione (PMS), registri dei pazienti, sviluppo e diffusione di linee guida, raccomandazioni, ecc. che forniscono una ragionevole garanzia della sicurezza e dell'efficacia del dispositivo. Una presentazione abbreviata 510(k) che si basa su uno o più controlli speciali deve includere quanto segue. Una relazione sintetica che descriva l'aderenza ai controlli speciali e il modo in cui sono stati utilizzati durante lo sviluppo e il collaudo del dispositivo.
- Come i controlli speciali sono stati utilizzati per affrontare un rischio specifico o un problema.
- Informazioni che descrivono eventuali deviazioni dai controlli specifici e i tentativi del produttore di rispettarli.
- Standard di consenso volontario: È necessario fornire una DoC allo standard riconosciuto per una presentazione 510(k) abbreviata che si basa su di esso. Una DoC deve includere quanto segue:
- Il nome e l'indirizzo del richiedente/sponsor responsabile della DoC.
- Dettagli sull'identificazione del prodotto/dispositivo, compresi i codici del prodotto, il nome commerciale del dispositivo, il numero di modello e qualsiasi altro dato di identificazione univoca del prodotto specifico per la DoC in questione.
- Una dichiarazione di conformità.
- Un elenco degli standard per i quali la DoC è applicabile, compresa l'opzione o le opzioni selezionate per ogni standard, se presenti.
- Il numeroFDA US per ciascuno standard.
- La data e il luogo di emissione della DoC.
- La firma, il nome stampato e la funzione dello sponsor responsabile della DoC.
- Eventuali limitazioni alla validità della dichiarazione (ad esempio, per quanto tempo la dichiarazione è valida, cosa è stato testato, concessioni fatte sui risultati del test, ecc.
In conclusione, un 510(k) abbreviato è un modo utile per i produttori di dispositivi per dimostrare un'equivalenza sostanziale a standard riconosciuti o controlli speciali utilizzando una DoC. Per qualificarsi per un 510(k) abbreviato, i produttori di dispositivi devono fornire un rapporto riassuntivo che spieghi la loro adesione ai documenti guida pertinenti, dimostrare la conformità ai controlli speciali e fornire DoC agli standard riconosciuti. È, tuttavia, importante notare che il processo di approvazione, la documentazione e il costo di un 510(k) abbreviato sono simili a quelli di un 510(k) tradizionale.
Il vostro dispositivo medico è idoneo per una domanda abbreviata 510(k)? Per qualsiasi assistenza nella presentazione della vostra domanda abbreviata 510(k), reach il nostroesperto in materia di normative. Rimanete informati! Rimanete conformi!









