
Quando uno stabilimento straniero si occupa della produzione di un dispositivo medico importato negli Stati Uniti (US), è obbligatorio designare un US per tale stabilimento. US funge da punto di contatto per qualsiasi comunicazione US and Drug Administration (FDAUS relativa alla struttura registrata all'estero. Poiché tali comunicazioni possono essere urgenti, è fondamentale che US abbia una conoscenza approfondita delle FDA US e sia in grado di fornire consulenza allo stabilimento straniero in merito alla conformità ai requisitiFDA US in materia di dispositivi medici. Inoltre, avere un US indipendente aiuta a prevenire potenziali conflitti di interesse che potrebbero sorgere quando un partner commerciale viene designato come US . In questo blog approfondiremo i dettagli della registrazione di uno stabilimento straniero presso laFDA US .
Che cos'è la registrazione dello stabilimento?
La registrazione annuale presso la FDA US è obbligatoria per produttori a contratto, importatori iniziali, riconfezionatori/rietchettatori, sviluppatori di specifiche, ecc., di stabilimenti impegnati nella produzione e distribuzione di dispositivi medici destinati al mercato degli US, una procedura denominata Registrazione dello Stabilimento (Titolo 21 CFR Parte 807).
Who deve richiedere la registrazione dello stabilimento?
I proprietari delle strutture che si occupano della produzione e distribuzione di dispositivi medici destinati all'uso negli US devono completare una registrazione annuale presso la FDA degli US. I tipi di proprietari che possono richiedere la registrazione dello stabilimento sono:
- Proprietari di stabilimenti domestici
- Proprietari di stabilimenti esteri
- Produttori a contratto
- Importatori iniziali
- Confezionatori/etichettatori
- Sviluppatori di specifiche
Quali sono le fasi del processo di registrazione dello stabilimento?
Per registrare un'azienda produttrice di dispositivi medici presso laFDA US , è necessario seguire i passaggi indicati nel diagramma di flusso riportato di seguito.
Figura 1: Fasi del processo di registrazione dello stabilimento
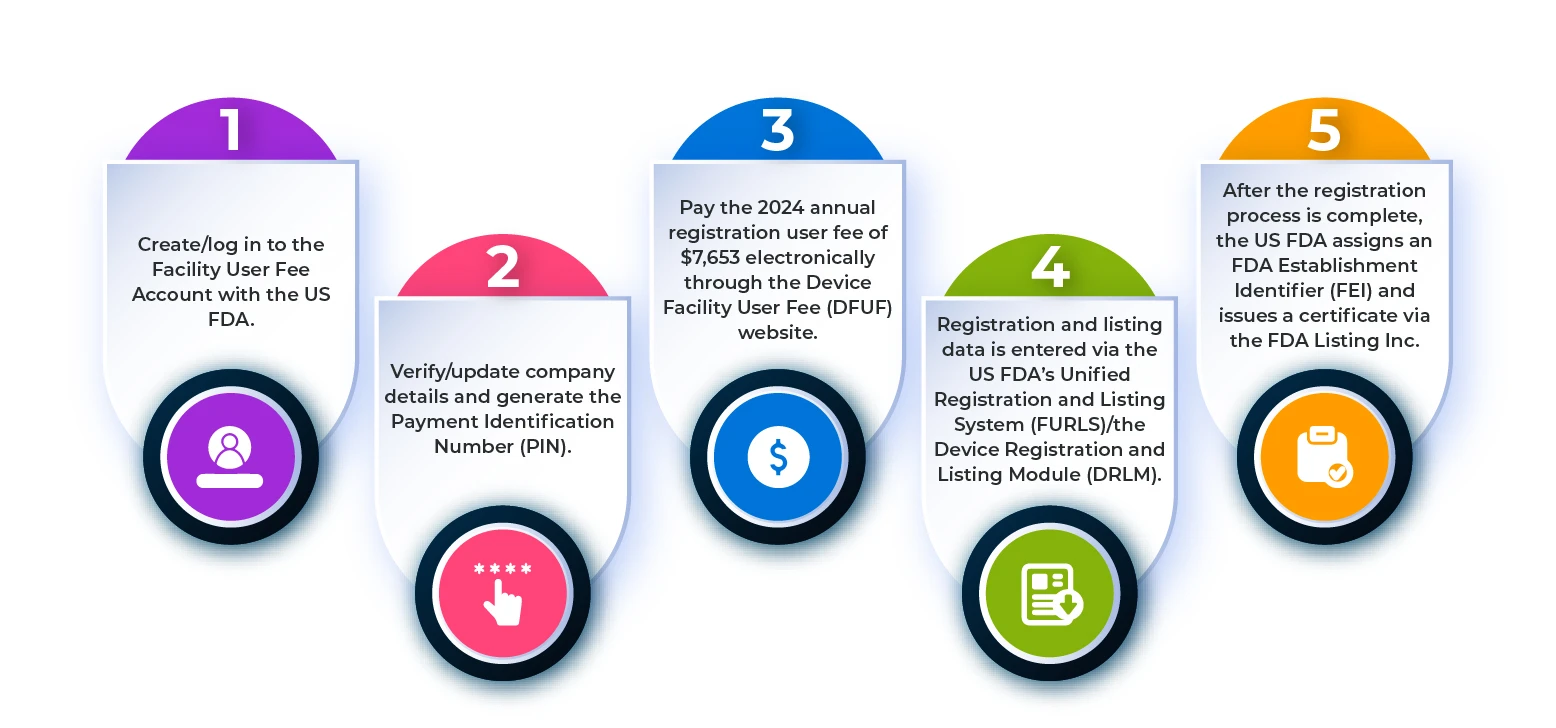
Quali sono i requisiti per la registrazione e la quotazione degli stabilimenti esteri?
Comprendere l'importanza di scegliere un US indipendente ed esperto aiuterà un'azienda straniera a dare priorità all'eliminazione di qualsiasi conflitto di interessi, aspetto fondamentale per le aziende che si muovono nel complesso mondo della FDA US . Le aziende straniere devono rafforzare la loro comprensione dei prerequisiti per ottenere la conformità, promuovere solide partnership con US e preparare il terreno per un processo di registrazione senza intoppi. La tabella seguente illustra i requisiti di registrazione e inserimento nell'elenco in base alle attività di un'azienda straniera. Indica inoltre quali attività comportano una tassa di registrazione dell'azienda.
Tabella 1: Requisiti per la registrazione e la quotazione in base alle attività di una società estera
| Attività | Registro | Elenco | Pagare la tassa | |
| Fabbricante a contratto (compresi i confezionatori a contratto) | SÌ 807.40 (a) | SÌ 807.40 (a) | SÌ | |
| Sterilizzatore a contratto | SÌ 807.40 (a) | SÌ 807.40 (a) | SÌ | |
| Produttori di dispositivi personalizzati | SÌ 807.20 (a) (2) | SÌ 807.20 (a) (2) | SÌ | |
| Dispositivo in fase di sperimentazione in base all'esenzione per i dispositivi in fase di sperimentazione (IDE) | NO 812.1 (a) | NO 812.1(a),807.40 (c) | NO | |
| Esportatore straniero di dispositivi situati in un paese straniero | SÌ 807.40 (a) | SÌ 807.40 (a) | SÌ | |
| Produttori stranieri (inclusi gli Assemblatori di Kit) | SÌ 807.40 (a) | SÌ 807.40 (a) | SÌ | |
| Conserva i file dei reclami come richiesto dalla norma 21 CFR 820.198. | SÌ | SÌ | SÌ | |
| Fabbricante di accessori confezionati o etichettati per la distribuzione commerciale ad un utente finale per scopi sanitari | SÌ 807.20 (a) (5) | SÌ 807.20 (a) (5) | SÌ | |
| Produttore di componenti che vengono distribuiti solo a un produttore di dispositivi finiti | NO 807.65 (a) | NO | NO | |
| Rilegatori o riconfezionatori | SÌ 807.20 (a) (3) | SÌ 807.20 (a) (3) | SÌ | |
| Rifabbricante | SÌ | SÌ | SÌ | |
| Ricondizionatore di dispositivi monouso | SÌ 807.20 (a) | SÌ 807.20 (a) | SÌ | |
| Sviluppatori di specifiche | SÌ | SÌ | SÌ | |
La registrazione dello stabilimento presso la FDA degli US è un requisito essenziale per gli stabilimenti esteri coinvolti nella produzione, vendita, riconfezionamento o importazione di dispositivi medici negli US. Questa registrazione garantisce la conformità alle severe normative e standard della FDA degli US. Freyr fornisce un supporto prezioso agli stabilimenti che cercano una guida esperta durante il processo di registrazione dello stabilimento. Sfruttando la propria esperienza e comprensione delle normative della FDA degli US, Freyr assiste gli stabilimenti esteri nel soddisfare i requisiti di conformità, portando in ultima analisi a un ingresso più agevole ed efficiente nel mercato dei dispositivi medici degli US. Per saperne di più sul processo di registrazione dello stabilimento presso la FDA degli US, contattateci oggi stesso. Rimanete informati! Rimanete conformi!









