
Il regolamento sui dispositivi medici (MDR) dell'Unione Europea (UE) è ormai da tempo al centro dell'attenzione. L'MDR ha sostituito la direttiva sui dispositivi medici (MDD) e la direttiva sui dispositivi impiantabili attivi (AIMDD). Inizialmente, la transizione completa avrebbe dovuto essere completata entro maggio 2020; tuttavia, a causa dell'emergenza pandemica da COVID-19, l'attuazione è stata posticipata al 26 maggio 2021. Entro il 26 maggio 2024, tutti i certificati MDD perderanno validità e i produttori di dispositivi produttori conformarsi EU MDR. Inoltre, i dispositivi MDD immessi legalmente sul mercato ai sensi delle direttive 90/385/CEE e 93/42/CEE prima del 26 maggio 2020 e i dispositivi immessi sul mercato a partire dal 26 maggio 2020 in virtù di un certificato continueranno ad essere disponibili sul mercato fino al 27 maggio 2025. Le tempistiche sono illustrate di seguito.
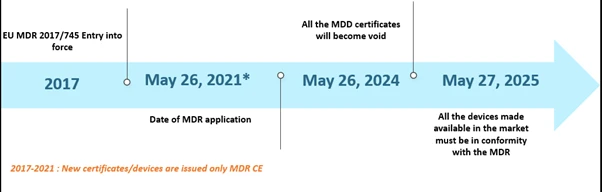
Cronologia degli scenari EU MDR
Tuttavia,la capacità limitata degli organismi notificati (ON) e l'impreparazione dei produttori alcune sfide nell'attuazione dell'MDR secondo la tempistica prevista. A ottobre 2022, i organismi notificati (ON) erano in totale trentotto (38) e avevano ricevuto circa 8120 domande di EU MDR , di cui 1990 certificati sono stati rilasciati. Secondo le loro stime con la tempistica iniziale, potevano essere elaborati solo 7000 certificati, il che ha portato a un'ulteriore proroga della tempistica. Inoltre, uno degli altri probabili motivi della proroga è stato quello di garantire la continua disponibilità di dispositivi medici sicuri i cui certificati sono già scaduti o scadranno prima del 26 maggio 2024. Lo scenario attuale per la proroga della tempistica è illustrato di seguito.
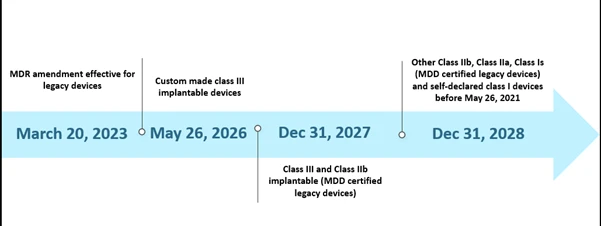
Cronologia degli scenari EU MDR
La nuova proroga è applicabile ai dispositivi esistenti che soddisfano l'articolo 120 (3e) con un marchio CE MDD valido o una deroga al 20 marzo 2023 e rimarranno sul mercato insieme ai dispositivi con marchio CE MDR. Entro il 26 maggio 2024, produttori dispositivi legacy dovranno aver implementato un sistema di gestione della qualità (QMS) e presentato una domanda di valutazione della conformità a un organismo notificato (NB) designato MDR, ed entro il 26 settembre 2024 produttori dispositivi legacy dovranno aver stipulato un accordo con un NB designato MDR.
Ora vediamo quale impatto produttori avere i produttori con questa estensione.
Opportunità che i produttori con questa estensione:
- Accesso al mercato ampliato per produttori di dispositivi certificati MDD/AIMDD produttori hanno già adottato le iniziative di conformità MDR.
- produttori certificati MDR produttori certificati CE MDD/AIMDD non sono stati revocati sono autorizzati a commercializzare dispositivi legacy fino alla fine del periodo di transizione, oltre ai loro dispositivi conformi all'MDR.
- produttori beneficiano di una deroga nazionale a partire dal 20 marzo 2023 possono beneficiare del periodo transitorio.
- Il periodo di proroga offre più tempo per una migliore comprensione delle norme e dei regolamenti, contribuendo a snellire il processo e a raggiungere la conformità MDR.
Sfide che potrebbero presentarsi per produttori questa estensione:
- Non vi è alcun vantaggio di mercato per produttori di dispositivi tradizionali produttori non hanno voluto conformarsi al regolamento MDR.
- L'estensione dell'MDR può causare un allungamento dei processi di certificazione e ritardare il lancio dei prodotti, come conseguenza diretta dell'arretrato delle revisioni da parte delle NB.
Quali azioni dovrebbero produttori ?
- È fondamentale che i produttori la classe di rischio MDR dei loro dispositivi medici per identificare tempestivamente il calendario di transizione appropriato in base alle norme MDR modificate.
- Per garantire la conformità con le normative MDR, è fondamentale identificare e avviare la comunicazione con gli NB designati MDR in possesso delle competenze specifiche richieste per la classificazione del vostro dispositivo medico.
- È fondamentale eseguire una valutazione completa delle lacune per i dispositivi medici certificati ai sensi della MDD/AIMDD, identificare e risolvere eventuali non conformità con le normative MDR e garantire la conformità tempestiva.
È fondamentale che produttori immediatamente produttori garantire la conformità al regolamento MDR. La proroga dei termini offre produttori alcune opportunità produttori la conformità al regolamento MDR, ma presenta anche alcune sfide, come il ritardo nei processi di certificazione e i costi di conformità. Per affrontare queste sfide e sfruttare le opportunità, affidatevi al nostro team di professionisti che vi assisterà nel processo di conformità al regolamento MDR e garantirà il vostro successo in questo difficile contesto normativo. Prenotate oggi stesso un appuntamento con noiper saperne di più su come possiamo aiutarvi a raggiungere la conformità al regolamento MDR e a rimanere all'avanguardia. Rimanete informati. Rimanete conformi.









