
Quality Management System (QMS) una componente essenziale dell'industria dei dispositivi medici, che garantisce la sicurezza, l'efficacia e la conformità normativa dei dispositivi medici durante tutto il loro ciclo di vita. Il SGQ viene implementato in tutte le fasi del ciclo di vita dei dispositivi medici, compresa la fase di progettazione e sviluppo, per garantire che il dispositivo soddisfi i requisiti normativi e degli utenti e che eventuali rischi potenziali vengano identificati e affrontati.
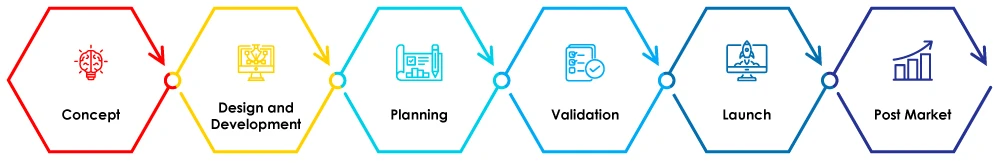
Figura 1 - Fasi del ciclo di vita dei dispositivi medici
In questo blog discuteremo dell'importanza del SGQ nella fase di progettazione e sviluppo del ciclo di vita dei dispositivi medici.
Fase di progettazione e sviluppo nel ciclo di vita dei dispositivi medici
La fase di progettazione e sviluppo è una delle fasi più critiche del ciclo di vita di un dispositivo medico. In questa fase si sviluppa il progetto del dispositivo e si creano i prototipi, seguiti da test di verifica e convalida come parte del ciclo di vita del dispositivo medico.
Per garantire che il dispositivo medico soddisfi i requisiti normativi, la sicurezza, l'efficacia e le aspettative degli utenti, l'implementazione di un Quality Management System (QMS) è essenziale nella fase di progettazione e sviluppo del ciclo di vita di un dispositivo medico.
La documentazione è fondamentale durante la fase di progettazione e sviluppo dei dispositivi medici. Il SGQ assicura che tutta la documentazione relativa alla progettazione e allo sviluppo sia controllata, gestita e documentata.
Il Design History File (DHF) un importante file/registro che contiene tutta la documentazione relativa alla progettazione e allo sviluppo del dispositivo. Il DHF fornisce la prova che la progettazione del dispositivo soddisfa i requisiti normativi.
Il DHF deve contenere la documentazione relativa agli input della progettazione, agli output della progettazione, alle revisioni della progettazione, alla verifica della progettazione, alla convalida, alle modifiche alla progettazione e alla gestione del rischio. Per saperne di più sul DHF, cliccate qui.
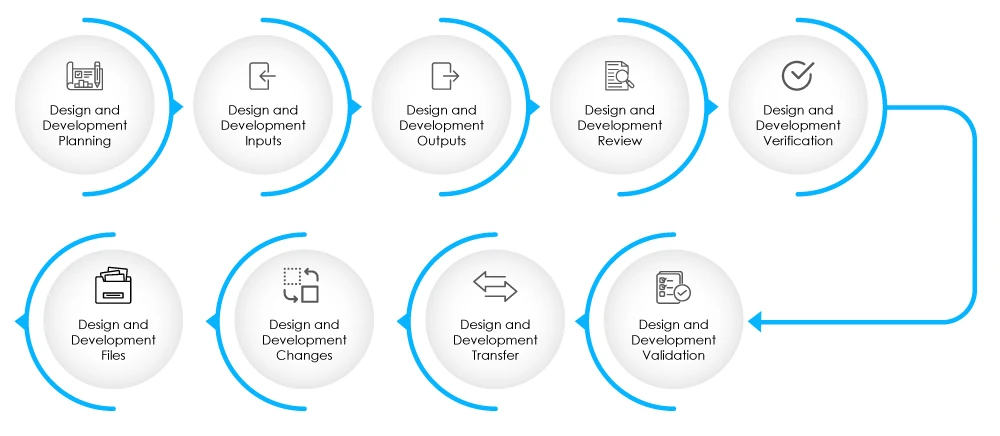
Fig. 2 - Fasi di progettazione e sviluppo
Migliori pratiche per la fase di progettazione e sviluppo
- Stabilire un approccio strutturato: Sviluppare un approccio strutturato allo sviluppo e alla gestione dei DHF che sia adattato alle esigenze specifiche della vostra organizzazione. Questo approccio deve includere linee guida, procedure e flussi di lavoro chiari per lo sviluppo e la gestione dei DHF.
- Definizione e documentazione degli input di progettazione: Definire e documentare chiaramente gli input di progettazione, compresi i requisiti e le specifiche del dispositivo. Ciò può contribuire a garantire che il DHF sia completo ed esaustivo.
- Gestire le modifiche alla progettazione: Implementare un solido processo di gestione delle modifiche che includa procedure per documentare, valutare e approvare le modifiche alla progettazione. In questo modo si può garantire che le modifiche siano adeguatamente documentate e valutate per il loro impatto sulla sicurezza e sull'efficacia del dispositivo.
- Garantire la tracciabilità: Sviluppare una matrice di tracciabilità che colleghi gli input di progettazione agli output di progettazione e garantire che tutte le attività di progettazione e sviluppo siano adeguatamente documentate e registrate. Ciò può contribuire a garantire la tracciabilità del DHF e la buona documentazione del processo decisionale.
- Bilanciare innovazione e conformità: Sviluppare una cultura dell'innovazione garantendo al contempo il rispetto dei requisiti di conformità relativi alla DHF, come i controlli di progettazione e la gestione del rischio. Questo obiettivo può essere raggiunto sviluppando procedure e flussi di lavoro che facilitino l'innovazione, garantendo al contempo il rispetto dei requisiti normativi.
- Implementare il controllo dei documenti: Implementare procedure di controllo dei documenti che assicurino che i documenti DHF siano adeguatamente controllati, controllati nella versione e accessibili al personale autorizzato. In questo modo si può garantire che i documenti DHF siano sicuri e che le modifiche siano adeguatamente documentate e approvate.
- Formare il team: Assicurarsi che il team responsabile dello sviluppo e della gestione del DHF sia adeguatamente formato sui requisiti del DHF e abbia le competenze tecniche necessarie per sviluppare il prodotto. Questo obiettivo può essere raggiunto attraverso sessioni di formazione regolari, mentoring e l'assunzione di professionisti esperti con le capacità e le competenze necessarie.
Seguendo queste best practice, l'industria dei dispositivi medici può garantire la conformità ai requisiti normativi, promuovere la sicurezza e l'efficacia dei propri prodotti e mantenere il proprio vantaggio competitivo sul mercato.
In conclusione, l'implementazione di un SGQ fin dalla fase di progettazione e sviluppo è fondamentale per il successo nel settore dei dispositivi medici, altamente regolamentato. Mantenendo registrazioni sistematiche e rispettando i requisiti normativi, l'industria dei dispositivi medici può garantire la fornitura di prodotti di alta qualità e la soddisfazione dei clienti.
In Freyr, offriamo servizi QMS per aiutare l'industria dei dispositivi medici a soddisfare i requisiti normativi in tutte le fasi del ciclo di vita del dispositivo medico. Contatta i nostri esperti QMS e normativi per saperne di più.









