Przegląd rejestracji urządzeń medycznych w Nowej Zelandii
wyroby medyczne Nowej Zelandii są regulowane przez nowozelandzki urząd wyroby medyczne leków i wyroby medyczne (Medsafe) zgodnie z przepisami dotyczącymi leków z 1984 r., ustawą o lekach z 1981 r. oraz przepisami dotyczącymi leków (baza danych wyroby medyczne) z 2003 r. Chociaż zatwierdzenie przed wprowadzeniem do obrotu nie jest konieczne, konieczne jest umieszczenie produktów w bazie danych systemu Electronic Web Assisted Notification of Devices (WAND) w ciągu 30 dni od wprowadzenia do obrotu. Medsafe może zażądać dokumentacji potwierdzającej bezpieczeństwo i skuteczność, takiej jak certyfikaty wydane przez uznane organy, np. jednostkę notyfikowaną UE lub Health Canada.
Zespół ekspertów ds. regulacji urządzeń medycznych firmy Freyr posiada bogate doświadczenie w zakresie wspierania firm produkujących urządzenia medyczne w procesie rejestracji wyroby medyczne nowozelandzkiej agencji Medsafe.

Organ regulacyjny: Urząd wyroby medyczne (Medsafe)
Rozporządzenie:Rozporządzenie w sprawie wyroby medyczne(baza danych wyroby medyczne) z 2003 r.
Ustawa o lekach z 1981 r.
Rozporządzenie w sprawie leków z 1984 r.
Ścieżka regulacyjna: Elektroniczny system powiadamiania o urządzeniach wspomagany przez Internet (WAND)
Upoważniony przedstawiciel: Sponsor urządzenia medycznego
Wymóg SZJ: Certyfikat ISO 13485:2016
Ocena danych technicznych: Urząd wyroby medyczne (Medsafe)
Ważność licencji: Listy urządzeń w Nowej Zelandii nie wygasają. Urządzenia uznane za stanowiące poważne zagrożenie dla społeczeństwa mogą zostać usunięte z rynku.
Wymagania dotyczące etykietowania: Przepis 12(4) Rozporządzenia o lekach z 1984 r. i GHTF/SG1/N43:2005
Format zgłoszenia: Elektroniczny system powiadamiania o urządzeniach wspomagany przez Internet (WAND)
Język: Angielski
Klasyfikacja urządzeń medycznych w Nowej Zelandii
wyroby medyczne Nowej Zelandii są klasyfikowane według ryzyka do klas I, IIa, IIb, III i AIMD zgodnie z kryteriami Międzynarodowego Forum Organów Regulacyjnych ds. Wyrobów Medycznych (IMDRF). Klasyfikacja ta ma wpływ na zakres niezbędnej kontroli regulacyjnej. Klasyfikacja opiera się na takich cechach, jak przeznaczenie urządzenia, czas kontaktu z ciałem, inwazyjność oraz to, czy jest ono aktywne, czy nieaktywne. Urządzenia wyższej klasy podlegają bardziej rygorystycznemu nadzorowi regulacyjnemu. Medsafe jest organem regulacyjnym w Nowej Zelandii, który nadzoruje te klasyfikacje i regulacje.
| Klasyfikacja wyrobów medycznych Medsafe innych niż IVD Klasa | Ryzyko |
|---|---|
| Klasa I Podstawowa | Niskie ryzyko |
| Pomiar klasy I | Niskie ryzyko |
| Klasa I sterylności | Niskie ryzyko |
| Klasa IIa | Niskie-średnie ryzyko |
| Klasa IIb | Średnio wysokie ryzyko |
| Klasa III i aktywny wyrób medyczny do implantacji (AIMD) | Wysokie ryzyko |
| Klasyfikacja Medsafe IVD | Ryzyko |
|---|---|
| Od lipca 2014 r. Medsafe nie uznaje żadnego systemu klasyfikacji ryzyka dla wyrobów medycznych do diagnostyki in vitro. Wszystkie wyroby medyczne do diagnostyki in vitro zgłoszone do WAND muszą używać kodu klasyfikacji ryzyka wyrobów medycznych do diagnostyki in vitro. Dyrektor generalny ds. zdrowia zatwierdził zwolnienie dla wyrobów medycznych do diagnostyki in vitro zgodnie z załącznikiem 1, pkt (i) rozporządzenia w sprawie wyrobów medycznych (baza danych wyroby medyczne) z 2003 r. Jednak dostawcy wyrobów IVD mogą dobrowolnie zgłaszać swoje wyroby do bazy danych. | |
Autoryzowany przedstawiciel/sponsor urządzenia medycznego
Autoryzowany Przedstawiciel jest określany jako Sponsor i działa jako pośrednik pomiędzy producentem a Medsafe. Sponsorzy służą jako przedstawiciele regulacyjni dla produktów wprowadzanych do obrotu w Nowej Zelandii, składając wnioski WAND i działając jako główny punkt kontaktowy między producentem a Medsafe we wszystkich sprawach związanych z produktem. Ponadto Medsafe rozlicza sponsora z działań w zakresie czujności.
Rejestracja urządzeń medycznych w Nowej Zelandii
Procedura rejestracji urządzeń medycznych w Nowej Zelandii i procedura wpisu na listę WAND w Nowej Zelandii różni się w zależności od klasy urządzenia.
Urządzenia klasy I - deklaracja zgodności producenta jest wymagana dla niesterylnych, niepomiarowych urządzeń klasy I; jednak rzadko jest ona składana do organu regulacyjnego. Zamiast tego sponsor (lub dostawca) musi wprowadzić dane urządzenia do bazy danych Web Assisted Notification of Devices (WAND) w ramach procesu powiadamiania Medsafe.
Urządzenia innych klas
W Nowej Zelandii sponsorzy lub dostawcy mają obowiązek zapewnić wyroby medyczne normami takimi jak ISO 13485:2016. Bezpośrednie przedłożenie deklaracji zgodności, certyfikatu QMS lub dowodów produkcji do Medsafe nie jest zazwyczaj wymagane. Jednak zachowanie tej dokumentacji ma kluczowe znaczenie dla wykazania zgodności na żądanie.
Medsafe przedkłada nadzór po wprowadzeniu do obrotu nad szczegółową procedurą zatwierdzania wyroby medyczne przed wprowadzeniem do obrotu. Chociaż audyty nie są rutynowo przeprowadzane na etapie zgłoszenia, Medsafe może je zainicjować w przypadku wyrobów o podwyższonym ryzyku lub w następstwie działań nadzorczych i zgłoszeń zdarzeń niepożądanych, zapewniając ciągłe bezpieczeństwo i zgodność z przepisami.
Po zgłoszeniu urządzenia do bazy danych WAND może ono być sprzedawane w Nowej Zelandii, pod warunkiem że dostawca konsekwentnie przestrzega przepisów Medsafe. Wymaga to ciągłej zgodności, zwłaszcza w zakresie monitorowania po wprowadzeniu do obrotu i standardów zgłaszania incydentów. Eksperci ds. urządzeń medycznych w Freyr usługi związane z przestrzeganiem tych wymogów regulacyjnych, zapewniając firmom zgodność z przepisami przez cały cykl życia produktu.
Przepływ procesu
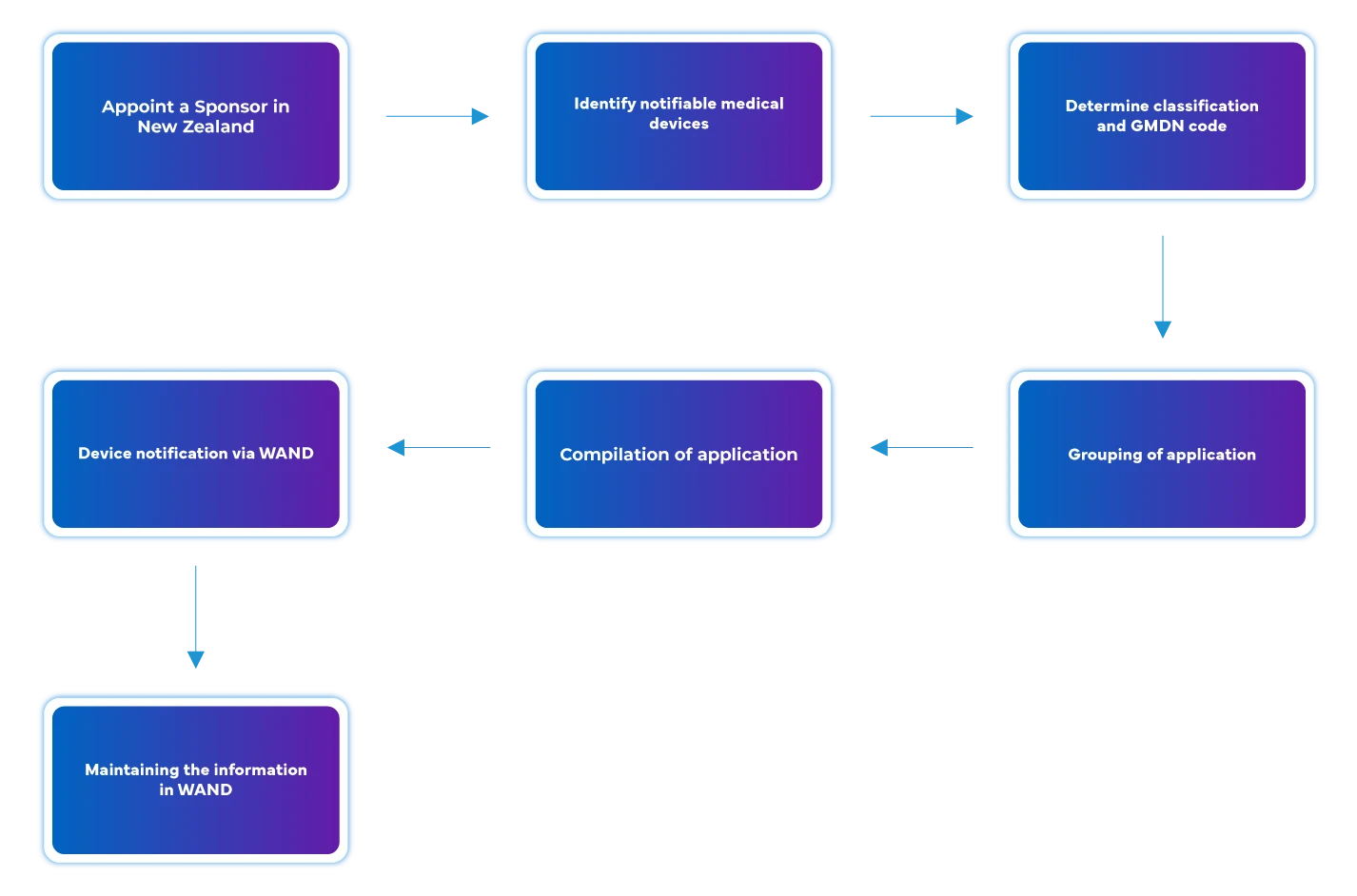
Zarządzanie cyklem życia urządzenia po zatwierdzeniu
Freyr wspiera zagranicznych producentów w end-to-end zarządzaniu cyklem życia urządzeń end-to-end , w tym w działaniach po uzyskaniu zatwierdzenia, powiadamiając władze Nowej Zelandii za pośrednictwem systemu WAND, np. –
- Zarządzanie zmianami po zatwierdzeniu - modyfikacje istniejących zatwierdzeń urządzeń medycznych, takie jak dodanie nowych wariantów, akcesoriów; dodanie nowych wskazań do stosowania.
- Utrzymanie zatwierdzeń i rejestracji.
Dzięki zespołowi specjalistów ds. regulacji prawnych Freyr producentom kompleksowe wsparcie w zakresie utrzymania standardów jakości i bezpieczeństwa wymaganych do uzyskania zezwolenia na wprowadzenie produktu do obrotu. Specjaliści ds. analizy regulacji prawnych skrupulatnie monitorują zmiany w przepisach, zapewniając klientom dostęp do aktualnych informacji na temat działań niezbędnych do utrzymania zgodności produktów z obowiązującymi normami.
Podsumowanie
| Ryzyko | Klasa urządzenia | Audyt QMS | Ścieżka regulacyjna | Harmonogramy Medsafe | Ważność rejestracji (w latach) |
|---|---|---|---|---|---|
| Niskie ryzyko | Klasa I Podstawowa | Zgodność z ISO 13485:2016 Uwaga – Medsafe nie wymaga audytów QMS, ale zdecydowanie zaleca stosowanie ISO 13485:2016 w zakresie jakości i bezpieczeństwa. Medsafe ma prawo przeprowadzać audyty QMS dla dowolnej klasy urządzeń, jeśli pojawią się obawy dotyczące bezpieczeństwa lub jakości. | Lista WAND (powiadomienie) | 1 tydzień |
Brak daty ważności |
| Niskie ryzyko | Pomiar klasy I | Lista WAND (powiadomienie) | |||
| Niskie ryzyko | Klasa I sterylności | Lista WAND (powiadomienie) | |||
| Niskie-średnie ryzyko | Klasa IIa | Lista WAND (powiadomienie) | |||
| Średnio wysokie ryzyko | Klasa IIb | Lista WAND (powiadomienie) | |||
| Wysokie ryzyko | Klasa III | Lista WAND (powiadomienie) |
Uwaga: Zgodnie z obowiązującymi przepisami wykazy urządzeń w Nowej Zelandii nie wygasają, ale urządzenia, które zostaną uznane za stwarzające niedopuszczalne ryzyko dla społeczeństwa, mogą zostać usunięte z rynku. Obecne przepisy mogą jednak zostać zmienione do 2026/2027 roku.
Ekspertyza Freyr
- Kompleksowa obsługa rejestracji urządzeń medycznych.
- Wsparcie LR
- Lista WAND
- Obsługa etykietowania
- Zarządzanie zmianami po zatwierdzeniu
- Przeniesienie licencji
- Składanie wniosków i usługi łączności z WAND
