Przegląd rejestracji wyrobówFDA US FDA
Stany Zjednoczone Ameryki (USA) są znane jako rynek wyroby medyczne podlegający ścisłej regulacji, wyroby medyczne jasno określonymi ścieżkami rejestracji i wymaganiami. Pierwsze przepisy dotyczące wyrobów medycznych w Stanach Zjednoczonych pochodzą z 1976 roku i ewoluowały na przestrzeni lat. Są one regulowane przez Centrum Urządzeń i Zdrowia Radiologicznego (CDRH) podlegające Agencji ds. Żywności i Leków (FDA). Freyr pomógł wielu producentom urządzeń medycznych w dostosowaniu się do procesu rejestracji wyrobówFDA US FDA .

Organ regulacyjny: Żywności i LekówFDA)
Rozporządzenie: Tytuł 21 Kodeksu Przepisów Federalnych (21 CFR), części 800-1299
Ścieżka regulacyjna: Powiadomienie przed wprowadzeniem do obrotu lub Zatwierdzenie przed wprowadzeniem na rynek lub Klasyfikacja De-Novo
Upoważniony przedstawiciel: Agent USA
Wymóg SZJ: Rozporządzenie w sprawie systemu jakości (QSR) (21 CFR część 820)
Ocena danych technicznych: Centrum Urządzeń i Zdrowia Radiologicznego
Ważność licencji: Bez ograniczeń
Wymagania dotyczące etykietowania: 21 CFR część 801
Format zgłoszenia: Papier i płyty CD/DVD
Język: Angielski
Klasyfikacja urządzeń medycznych USA
FDA wyroby medyczne trzech kategorii opartych na ryzyku: klasa I, klasa II i klasa III, przy czym wyroby klasy I są uznawane za wyroby niskiego ryzyka, a wyroby klasy III są związane z wysokim ryzykiem. Wymogi rejestracyjne i ścieżka rejestracyjna różnią się w zależności od klasy wyrobu.
| Klasa urządzenia | Ryzyko | Ścieżka rejestracji do zatwierdzenia |
|---|---|---|
| I | Niskie ryzyko | 510(k) zwolniony |
| II | Umiarkowane ryzyko (Z urządzeniem predykatu) | Powiadomienie przed wprowadzeniem do obrotu/510(k) |
Umiarkowane ryzyko (Bez urządzenia predykatu) | Aplikacja De-Novo | |
| III | Wysokie ryzyko | Zatwierdzenie przed wprowadzeniem do obrotu (PMA) |
Amerykański agent FDA
Firmy, które nie mają lokalnych biur w Stanach Zjednoczonych, muszą wyznaczyć FDA w Stanach Zjednoczonych,który będzie reprezentował producenta. FDA w Stanach Zjednoczonych musi mieszkać w Stanach Zjednoczonych lub mieć siedzibę firmy w Stanach Zjednoczonych. Obowiązki przedstawiciela są z góry określone przezFDA ramach przepisów CFR.
Przejrzyjczęsto zadawane pytania (FAQ) dotyczące US .
Interaktywne spotkania z US agencjąFDA
US FDA producentów poprzez różnego rodzaju spotkaniadotyczące składania wniosków jakościowych (Q-Submission), aby osiągnąć różne cele. Takie spotkania z agencją przed rozpoczęciem lub w trakcie opracowywania urządzenia, przed złożeniem wniosków o rejestrację urządzeńFDA US FDA , pomagają producentom zoptymalizować harmonogramy i koszty związane z komercjalizacją urządzeń.
Rejestracja urządzeń medycznych USA
Urządzenia te mogą zostać zatwierdzone przez CDRH, FDA za pośrednictwem jednej z różnych ścieżek rejestracji. Są one wymienione jako:
wyroby medyczne klasy I:Wyroby klasy I są zazwyczaj zwolnione z wymogu przedłożenia dokumentacji GMP i 510(k) i nie wymagają uprzedniej zgody US agencjiFDA wprowadzenie ich do obrotu w Stanach Zjednoczonych. Producent musi jednak spełnić inne wymagania, takie jak rejestracja zakładu, wykaz wyrobów, UDI, PMS itp.
wyroby medyczne klasy II:Wyroby o średnim ryzyku, posiadające wyroby referencyjne zatwierdzone zgodnie z procedurą 510(k), mogą zostać zgłoszone zgodnie z procedurą 510(k) Pre-market Notification (PMN), zwaną równieżrejestracją 510(k). Dane urządzenie musi wykazać istotną równoważność (SE) z określonymi i zgłoszonymi urządzeniami referencyjnymi. Ta ścieżka jest najczęściej stosowaną ścieżką rejestracji urządzeń w Stanach Zjednoczonych. Producenci urządzeń średniego ryzyka bez urządzeń referencyjnych mogą wystąpić o klasyfikację przez US agencjęFDA złożenie wniosków De-Novo.
wyroby medyczne klasy III:Producenci wyrobów medycznych wysokiego ryzyka klasy III muszą złożyć wniosek o zatwierdzenie przed wprowadzeniem do obrotu (PMA) doUS agencjiFDA. Wyroby muszą przejść szczegółową ocenę kliniczną, a producent musi przedłożyć szczegółowe dane dotyczące bezpieczeństwa i skuteczności pochodzące z badań klinicznych.US agencjaFDA kontrolę systemu zarządzania jakością w ramach oceny przed wydaniemzatwierdzenia przed wprowadzeniem do obrotudla danego wyrobu.
Rejestracje urządzeń medycznych inne niż CDRH
W oparciu o wskazania dotyczące stosowania, niektóre produkty graniczne uznawane za wyroby medyczne innych krajach, takie jak maski chirurgiczne, środki dezynfekujące, produkty złożone, wymagają zaangażowania innych agencji, takich jak Centrum Kontroli Chorób (CDC), Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH), Agencja Ochrony Środowiska (EPA), Centrum Oceny i Badań Biologicznych (CBER) oraz Centrum Oceny i Badań Leków (CDER).
Wymogi dotyczące zgodności po zatwierdzeniu wyroby medyczne
Wszyscy producenci urządzeń muszą spełniać poniższe wymagania po zatwierdzeniu:
- Wymagania dotyczące rejestracji i notowań: Zakłady wszystkich klas urządzeń muszą być zarejestrowane w bazie danych FURL, a urządzenie musi być wymienione po uzyskaniu zatwierdzenia i przed wprowadzeniem urządzenia do obrotu w USA. Niektóre urządzenia, takie jak urządzenia radiacyjne, muszą spełniać inne wymagania, takie jak numer akcesyjny, zanim będą mogły być importowane do USA.
- Unikalna identyfikacja urządzenia: Wszystkie klasy urządzeń muszą być zgodne z przepisami Unique Device Identification (UDI ), aby móc wprowadzać urządzenia na rynek amerykański.
- Opłaty za założenie: Producent musi uiścić roczne opłaty za rejestrację zakładu, aby utrzymać aktywną rejestrację zakładu i kontynuować sprzedaż urządzeń w Stanach Zjednoczonych. US AgencjaFDA strukturę opłat dla mniejszych podmiotów posiadających aktywny certyfikat małej firmy.
- Audyty jakości: W przypadkuurządzeń, które nie są zwolnione z wymogów GMP,US agencjaFDA w dowolnym momencie przeprowadzić kontrolę zakładu produkcyjnego pod kątem zgodności z przepisami dotyczącymi systemów jakości (QSR) zgodnie z 21 CFR 820.
Przepływ procesu
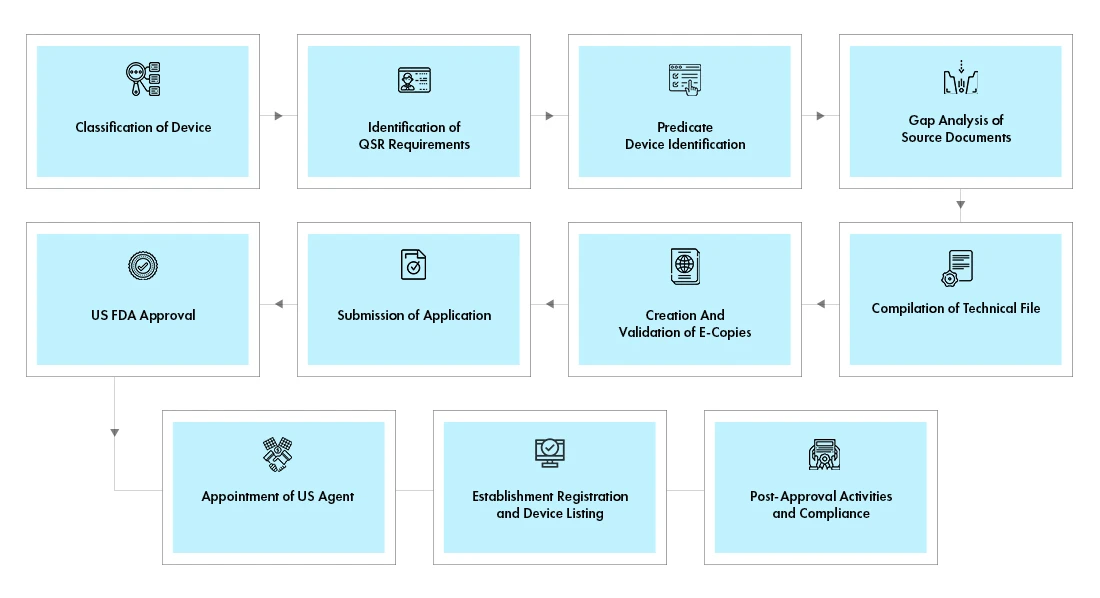
Zarządzanie cyklem życia urządzenia po zatwierdzeniu
Freyr wspiera zagranicznych producentów w end-to-end zarządzaniu cyklem życia wyrobów end-to-end , w tym w działaniach po uzyskaniu zatwierdzenia, takich jak:
- Zarządzanie zmianami po zatwierdzeniu - modyfikacje istniejących zatwierdzeń urządzeń medycznych, takie jak dodanie nowych wariantów, akcesoriów; dodanie nowych wskazań do stosowania, między innymi
- Utrzymanie zatwierdzeń i rejestracji poprzez terminowe uiszczanie opłat MDUFA na rzecz FDA
- Współpraca między US agencjąFDA producentem
Freyr posiada wyłączne centrum dostaw w USA z profesjonalnym zespołem zapewniającym wsparcie regulacyjne dla producentów w zakresie utrzymania jakości i bezpieczeństwa wymaganego do zatwierdzenia. Eksperci Freyruważnie obserwują aktualizacje przepisów i informują klientów o krokach, które należy podjąć w celu zapewnienia zgodności produktu z obowiązującymi normami.
Podsumowanie
| Ryzyko | Klasa urządzenia | Audyt QMS | Dostępność predykatu | Ścieżka regulacyjna | Agent USA | US FDA |
|---|---|---|---|---|---|---|
| Niskie ryzyko | I | Nie | NA | Zwolniony | Tak | 1 Miesiąc |
| Średnie ryzyko | II | Tak (po zatwierdzeniu) | Tak | PMN/510(k) | Tak | 9 - 12 miesięcy |
| Średnie ryzyko | II | Tak (po zatwierdzeniu) | Nie | Wniosek o zmianę klasyfikacji | Tak | 18 - 30 miesięcy |
| Wysokie ryzyko | III | Tak (wstępne zatwierdzenie) | NA | PMA | Tak | 18 - 30 miesięcy |
Usługi rejestracji urządzeń medycznych Freyr
Ekspertyza Freyr
- Należyta staranność regulacyjna
- Dokumentacja urządzenia
- 513(g) wsparcie
- Rejestracja 510(k)
- Nowy wniosek o klasyfikację
- Rejestracja PMA
- 21 CFR 820 zgodność
- Wsparcie audytu BIMO
- MDSAP Zgodność
- Obsługa etykietowania
- Wsparcie przy publikowaniu i składaniu wniosków
- Agent USA
- Spotkania Q-Submission
- RFD i spotkania poprzedzające RFD
- Certyfikacja małych firm
- Rejestracja zakładu i wykaz urządzeń
- Zgodność z przepisami dotyczącymi promieniowania wyroby medyczne
- Zarządzanie zmianami po zatwierdzeniu
- Nadzór pozarynkowy
- Zgodność z UDI
- Doradztwo regulacyjne w zakresie usuwania braków