Przegląd rejestracji wyrobów Health Canada
Kanada, dzięki rygorystycznym wytycznym, posiada jeden z najlepszych systemów regulacyjnych na świecie w zakresie wyroby medyczne. W Kanadzie wszystkie wyroby medyczne regulowane przez Health Canada, Health Products and Food Branch, Therapeutic Products Directorate, wyroby medyczne . Health Canada wyroby medyczne oceny ich bezpieczeństwa, skuteczności i jakości przed dopuszczeniem do sprzedaży w Kanadzie zgodnie z kanadyjskim rozporządzeniem w sprawie wyrobów medycznych SOR/98-282, wprowadzonym w życie w 1998 r. Freyr aktywnym partnerem firm produkujących wyroby medyczne, pomagając im w przestrzeganiu wytycznych Health Canada dotyczących rejestracji wyrobów Health Canada .
Organ regulacyjny: Health Canada
Rozporządzenie: wyroby medyczne (SOR/98-282)
Upoważniony przedstawiciel: Niewymagane
Wymóg SZJ: Zgodność z ISO 13485:2016 jak Medical Device Single Audit Program MDSAP)
Ocena danych technicznych: Health Canada
Ważność licencji: Bez ograniczeń
Wymagania dotyczące etykietowania: Część 21 MDR (SOR/98-282)
Format zgłoszenia: Papier
Język: Angielski i francuski
Klasyfikacja wyrobów Health Canada
System klasyfikacji wyrobów Health Canada w znacznym stopniu opiera się na dyrektywie Rady Unii Europejskiej 93/42/EWG. Wiele zasad i interpretacji terminów jest podobnych do tych proponowanych przez Unię Europejską. Nie oznacza to jednak, że wyrób medyczny sklasyfikowany w jednej klasie zgodnie z systemem klasyfikacji Unii Europejskiej zostanie sklasyfikowany w tej samej klasie w oparciu o kanadyjski system klasyfikacji wyrobów medycznych. Wnioskodawca musi przestrzegać zasad określonych w przepisach, aby określić odpowiednią klasyfikację swojego wyrobu w Kanadzie.
Do stworzenia kanadyjskich zasad klasyfikacji wykorzystano następujące wskaźniki ryzyka stwarzanego przez dane urządzenie: stopień inwazyjności, czas trwania kontaktu, dotknięty układ ciała oraz skutki miejscowe i ogólnoustrojowe.
| Klasa urządzenia | Ryzyko |
|---|---|
| I | Niski |
| II | Niski-umiarkowany |
| III | Wysoki-umiarkowany |
| IV | Wysoki |
Autoryzowany przedstawiciel w Kanadzie
Producent nie ma obowiązku wyznaczenia upoważnionego przedstawiciela w Kanadzie. Dystrybutor musi jednak spełniać Health Canada dotyczące dobrych praktyk dystrybucyjnych (GDP).
Rejestracja urządzeń medycznych - Kanada
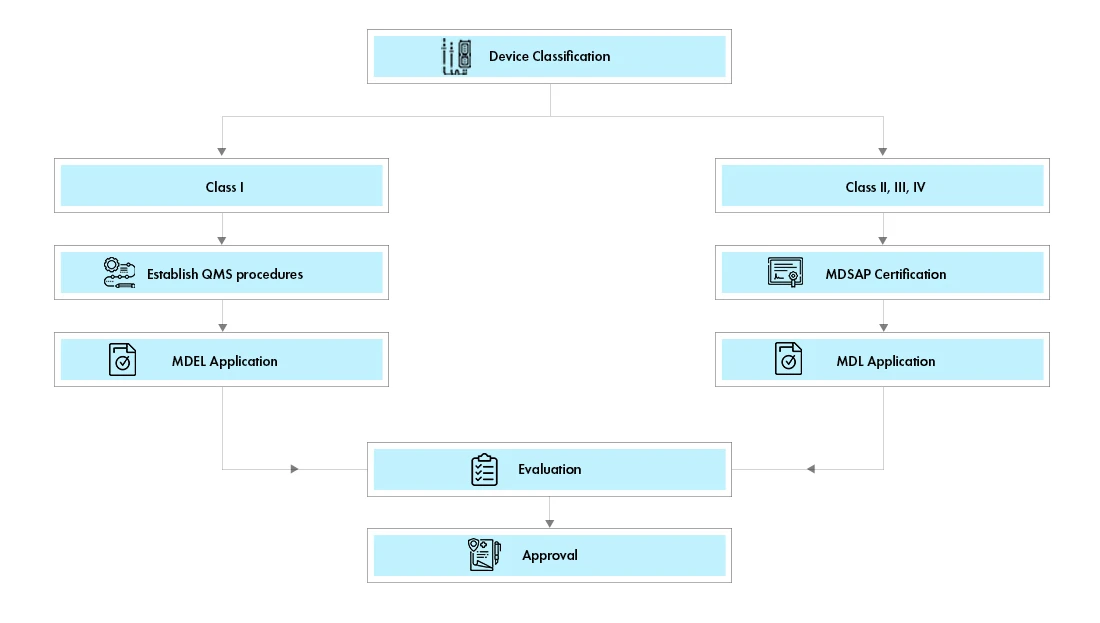
Istnieją dwie ścieżki rejestracji urządzeń medycznych w Kanadzie:
Licencja na prowadzenie działalności w zakresie wyrobów medycznych (MDEL):Urządzenia klasy I mogą ubiegać się o licencję na prowadzenie działalności w zakresie wyrobów medycznych w Kanadzie (MDEL) poprzez przygotowanie obowiązkowych procedur i uiszczenie Health Canada .
Licencja na urządzenie medyczne (MDL): Urządzenia klasy II, III i IV powinny ubiegać się o kanadyjską licencję dla urządzeń medycznych (MDL). Wymagania dotyczące dokumentów dla każdej z klas urządzeń są różne.
Przepływ procesu
Zarządzanie cyklem życia urządzenia po zatwierdzeniu
Freyr wspiera zagranicznych producentów w end-to-end zarządzaniu cyklem życia wyrobów end-to-end , w tym w działaniach po uzyskaniu zatwierdzenia, takich jak:
- Zarządzanie zmianami po zatwierdzeniu - modyfikacje istniejących zatwierdzeń urządzeń medycznych, takie jak dodanie nowych wariantów, akcesoriów; dodanie nowych wskazań do stosowania, między innymi
- Utrzymanie zatwierdzeń i rejestracji poprzez terminowe uiszczanie opłat administracyjnych i rejestracyjnych.
- Odnowienie licencji
- Współpraca między Health Canada producentem
Podsumowanie
| Ryzyko | Klasa urządzenia | Audyt QMS | Ścieżka regulacyjna | Wymagania dotyczące dokumentów | Health Canada |
|---|---|---|---|---|---|
| Niski | I | NA | MDEL |
| NA |
| Niski-umiarkowany | II | MDSAP | MDL |
| 15 dni |
| Wysoki-umiarkowany | III | MDSAP | MDL |
| 60 dni |
| Wysoki | IV | MDSAP | MDL |
| 75 dni |
Usługi rejestracji urządzeń medycznych Freyr
Ekspertyza Freyr
- Usługi klasyfikacji i grupowania wyrobów Health Canada
- Rejestracja urządzeń medycznych, Kanada
- Spotkania przed złożeniem wniosku z Health Canada
- MDSAP, Kanada
- Identyfikacja dystrybutora/Kwalifikacja dystrybutora pod kątem zgodności z Health Canada
- Kanadyjska licencja na zakładanie urządzeń medycznych (MDEL)
- Licencjonowanie urządzeń medycznych w Kanadzie (MDL)
- Zarządzanie zmianami po zatwierdzeniu
- Usługi etykietowaniazgodnie z wymogami Health Canada dotyczącymi Health Canada wyroby medyczne