Przegląd rejestracji urządzeń medycznych w Wielkiej Brytanii
Po brexicie Wielka Brytania nadal zmienia i uzupełnia przepisy dotyczące wyroby medyczne. Przepisy obowiązujące w tym kraju są podzielone geograficznie – Wielka Brytania (GB) i Irlandia Północna (NI).Agencja Regulacyjna ds. Leków i Produktów Opieki Zdrowotnej (MHRA)jest organem regulacyjnym zajmującym się wyrobami medycznymi. Irlandia Północna jest zobowiązana do przestrzegania wyroby medyczne Unii Europejskiejdotyczących wyroby medyczne (EU MDR) 2017/745orazprzepisów dotyczących wyrobów medycznych do diagnostyki in vitro (IVDR) 2017/746. Producenci spoza Wielkiej Brytanii muszą wyznaczyć osobę odpowiedzialną w Wielkiej Brytanii (UK RP), która pomoże im w przestrzeganiu tych przepisów i zapewni pomyślny przebieg procesu rejestracji wyrobów medycznych w Wielkiej Brytanii.
Organ regulacyjny: Agencja Regulacyjna ds. Leków i Produktów Opieki ZdrowotnejMHRA)
Rozporządzenie: wyroby medyczne (MDR) 2002*
Ścieżka regulacyjna: Oznakowanie CE, po którym następuje powiadomienie
Upoważniony przedstawiciel: Osoba odpowiedzialna z Wielkiej Brytanii (UK RP) dla producentów spoza Wielkiej Brytanii
Wymóg SZJ: ISO 13485:2016
Ocena danych technicznych: Zatwierdzone w Wielkiej Brytanii organy do znakowania UKCA
Ważne oznaczenia: GB - UKCA lub CE & NI - CE lub CE + UKNI
Format zgłoszenia: Papier
Format zgłoszenia: Online
*Przyszłe przepisy dotyczące wyroby medyczne obowiązywać od 1 lipca 2025 r.
Klasyfikacja urządzeń medycznych w Wielkiej Brytanii
Klasyfikacje urządzeń medycznych w Wielkiej Brytanii są oparte na UK MDR 2002. Klasyfikacja urządzenia jest pierwszym krokiem w całym procesie uzyskiwania zatwierdzenia i wprowadzania go na rynek.
Klasyfikacja urządzeń medycznych
| Klasa | Ryzyko |
|---|---|
| Klasa I | Niski |
| Klasa IIa | Średni |
| Klasa IIb | Średni |
| Klasa III | Wysoki |
Klasyfikacja IVD
- Ogólne IVD
- Samodzielne testowanie IVD
- Produkty IVD uwzględnione w wykazie A załącznika II
- IVD uwzględnione w wykazie B załącznika II
Nasza firma specjalizuje się w klasyfikacji urządzeń medycznych. Freyr z powodzeniem przeprowadził klasyfikację urządzeń dla ponad 50 firm w Wielkiej Brytanii.
Usługi brytyjskiej osoby odpowiedzialnej (UKRP)
Producenci spoza Wielkiej Brytanii są obecnie zobowiązani do obowiązkowego wyznaczenia UKRP w celu wprowadzenia produktów na rynek.
Freyr pomyślnie się zarejestrował i może teraz działać jako UKRP. Aby uzyskać więcej informacji na temat naszych usług UKRP, odwiedź stronę - www.ukrpservices.com
Rejestracja urządzeń medycznych
Producenci będą teraz musieli wyznaczyć zatwierdzony w Wielkiej Brytanii organ w celu uzyskania oznakowania UKCA. Chociaż oznakowanie CE jest dozwolone, ma ono zastosowanie tylko przez określony czas. Harmonogramy przejściowe dla tego samego są wymienione poniżej -
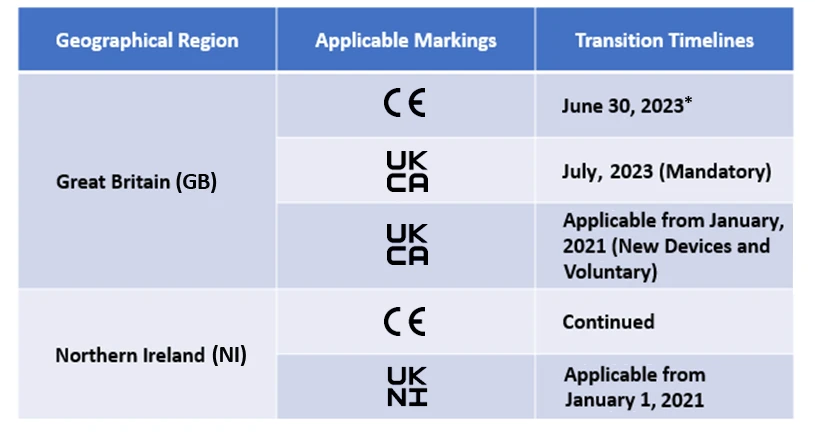
Freyr wspiera obecnie wielu producentów w procesie transformacji po Brexicie.
*Obecny harmonogram przejściowy dla oznakowania CE w ramach EU MDR IVDR jest uznawany przez UK MHRA , a harmonogramy będą się różnić w zależności od zakresu urządzeń.
Wymogi dotyczące nadzoru po wprowadzeniu do obrotu
Wymogi dotyczące nadzoru po wprowadzeniu do obrotu zgodnie z brytyjskim MDR 2002 są dość rygorystyczne, aby zapewnić bezpieczeństwo i skuteczność pacjentów/użytkowników. Obecnie działania PMS obejmują zgłaszanie incydentów/wykryć do MHRA. MHRA wydała kompleksowe wytyczne w tym zakresie.
Rejestracja urządzeń medycznych w Wielkiej Brytanii
Ekspertyza Freyr
- Klasyfikacja urządzeń medycznych w Wielkiej Brytanii
- Wsparcie w zakresie transformacji regulacyjnej po Brexicie
- Wsparcie regulacyjne dla brytyjskiej notyfikacji MHRA
- Osoba odpowiedzialna w Zjednoczonym Królestwie (UKRP)
- Współpraca i wsparcie agencji zdrowia i zatwierdzonego organu