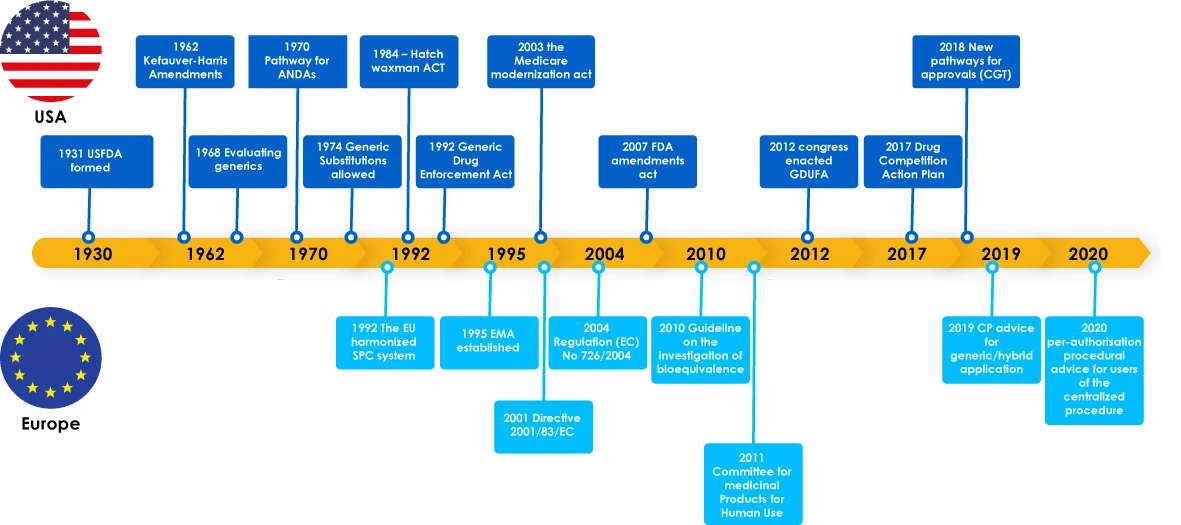
Ewolucja leków generycznych - przegląd
Leki generyczne osiągnęły główne kamienie milowe, w tym przepisy regulacyjne wspierające rozwój leków generycznych, które zachęciły producentów do eksploracji rynku leków generycznych. Przepisy te dały również lekarzom pewność, że mogą przepisać zamiennik leku markowego, co ostatecznie przyniosło korzyści pacjentom, ponieważ producenci leków generycznych zaspokoili krytyczne potrzeby pacjentów na całym świecie.
Najczęściej zadawane pytania dotyczące leków generycznych
P1: Czym są leki generyczne?
Leki generyczne to leki farmaceutyczne, które są identycznymi kopiami leku oryginalnego i mają takie samo API, dawkowanie, zamierzone zastosowanie, skutki uboczne, drogę podania, ryzyko, bezpieczeństwo i siłę działania jak lek innowacyjny, ale mogą różnić się niektórymi cechami, takimi jak proces produkcyjny, skład, substancje pomocnicze, kolor, smak i opakowanie. Innymi słowy, lek generyczny jest terapeutycznie równoważny z lekiem markowym i dlatego może być zastąpiony jego markowym odpowiednikiem.
Q2: Dlaczego leki generyczne kosztują mniej niż leki innowacyjne?
Leki generyczne są bardziej opłacalne w porównaniu z lekami innowacyjnymi, ponieważ leki generyczne nie muszą powtarzać kosztownych i długotrwałych badań przedklinicznych i klinicznych, które są wymagane w przypadku leków innowacyjnych w celu wykazania bezpieczeństwa i skuteczności, a zamiast tego leki generyczne muszą udowodnić jedynie równoważność farmaceutyczną swojego produktu.
P3: Czy leki generyczne są tak samo dobre jak leki innowacyjne?
Odpowiedź: Tak, leki generyczne mają taką samą jakość, skuteczność i są bezpieczne jak leki markowe. Niższa cena tych leków nie oznacza, że są one gorszej jakości, ponieważ leki generyczne, podobnie jak leki markowe, muszą przejść rygorystyczny proces zatwierdzania leków, aby wprowadzić je na rynek, a firmy farmaceutyczne są zobowiązane do złożenia wniosku o lek generyczny, wykazując, że ich produkt leczniczy ma takie same korzyści kliniczne jak leki markowe i nadaje się do stosowania jako substytut odpowiedniego leku markowego.
P4: Dlaczego leki generyczne wyglądają inaczej niż leki markowe?
Odpowiedź: Leki generyczne muszą być biorównoważne z lekami markowymi i mieć takie same API jak leki innowacyjne. Mogą jednak występować niewielkie różnice w lekach generycznych pod względem kształtu, etykietowania (niewielkie różnice), opakowania i nieaktywnych składników, takich jak kolor, aromaty i konserwanty; ale skuteczność leku musi pozostać taka sama.
Pytanie 5: Na czym polega proces rozpatrywania i zatwierdzania wniosków dotyczących leków generycznych w Stanach US?
Odp.: Każda firma farmaceutyczna, która chce wprowadzić swój produkt generyczny na rynek US spełniać wszystkie wymogi regulacyjne US FDAdotyczące rejestracji leków generycznych i wykazać, że:
- Lek generyczny jest "farmaceutycznie/terapeutycznie równoważny" z lekiem markowym.
- Producent jest w stanie prawidłowo i konsekwentnie wytwarzać lek.
- "Aktywny składnik" jest taki sam jak w marce
- Odpowiednia ilość składnika aktywnego dociera do miejsca w organizmie, w którym ma działanie
- "Nieaktywne" składniki leku są bezpieczne
- Lek nie rozkłada się z upływem czasu
- Pojemnik, w którym lek będzie wysyłany i sprzedawany, jest odpowiedni.
- Etykieta jest taka sama jak etykieta leku markowego
- Odpowiednie patenty lub wyłączności prawne wygasły
P6: Czy każdy lek markowy ma lek generyczny?
Odpowiedź: Nie. Każdy lek markowy nie ma wersji generycznej. Nowe leki są produkowane pod ochroną patentową przez okres do dwudziestu (20) lat. Oznacza to, że żaden inny lek nie może być produkowany i sprzedawany w tym okresie, aż do wygaśnięcia patentu. Jednak niektóre leki mogą nigdy nie mieć wersji generycznych ze względu na trudności w produkcji lub w przypadku, gdy lek generyczny może okazać się nieopłacalny.




