Clinical evaluation report (CER) wyroby medyczne
Każde urządzenie przeznaczone do wprowadzenia do obrotu w Unii Europejskiej (UE) musi posiadać oznaczenie CE. Zgodnie z rozporządzeniem EU MDR wymagania dotyczące Clinical Evaluation Report (CER), w tym wymagania dotyczące procesu i danych, różnią się w zależności od klasy urządzenia i są niezbędne do uzyskania certyfikatu CE dla wyroby medyczne. Urządzenia niskiego ryzyka klasy I mogą uzyskać certyfikat CE w ramach samocertyfikacji. Natomiast urządzenia innych klas (IIa, IIb, III) muszą uzyskać certyfikat znaku CE za pośrednictwem akredytowanej jednostki notyfikowanej (NB). Producent musi przedłożyć dokumentację techniczną CE do NB w celu oceny i wydania zatwierdzenia znaku CE oraz wydania certyfikatu CE. Clinical Evaluation Report (CER) wyroby medyczne przedłożyć wraz z dokumentacją techniczną CE, aby spełnić wymagania dotyczące oznakowania CE.
Clinical Evaluation Report (CER) wyroby medyczne jednym z raportów, które należy przedłożyć wraz z dokumentacją techniczną CE w celu spełnienia wymagań CER.
Czym jest Clinical Evaluation Report (CER)?
Sporządzanie raportu z oceny klinicznej obejmuje ocenę i analizę danych klinicznych dotyczących wyrobu medycznego w celu weryfikacji jego bezpieczeństwa klinicznego i działania. Ocena kliniczna wyroby medyczne na kompleksowej analizie danych klinicznych przed wprowadzeniem do obrotu i po wprowadzeniu do obrotu, istotnych dla zamierzonego zastosowania. Raport z oceny klinicznej zawiera dane dotyczące konkretnego wyrobu, a także wszelkie dane dotyczące wyrobów uznanych przez producenta za równoważne.
Raport z oceny klinicznej składa się z literatury naukowej i przeanalizowanych danych klinicznych, które zostały zebrane na podstawie badania klinicznego urządzenia lub wyników innych badań dotyczących zasadniczo równoważnych urządzeń. CER wyrobu medycznego wykazuje, że urządzenie osiąga zamierzony cel bez narażania użytkowników i pacjentów na dalsze ryzyko.
EU MDR CER musi być aktualizowany co roku. W przypadku, gdy wyrób jest wprowadzany do obrotu przez znaczny okres czasu i uznano, że jest bezpieczny i nie stwarza znaczącego ryzyka, CER można aktualizować co 2-5 lat. Wszelkie zmiany w projekcie urządzenia i wszelkie nowe informacje z danych PMS mogą spowodować aktualizację raportu CER.
Ocena kliniczna wyroby medyczne, określona w Clinical Evaluation Report (CER), opiera się na czynnikach wymienionych poniżej.
- Aktualnie dostępna literatura naukowa; i/lub
- Przeprowadzone badania kliniczne; lub
- Czy wykazanie zgodności z zasadniczymi wymaganiami na podstawie danych klinicznych nie jest uważane za właściwe?
Etapy pisania Clinical Evaluation Report (CER)
W odniesieniu do nowegowyroby medyczne (MDR) – 2017/745, istnieją cztery (04) różne etapy przeprowadzania oceny klinicznej wyroby medyczne przygotowania kompleksowegoClinical Evaluation Report (CER) zgodnie z rozporządzeniem UE MDR.
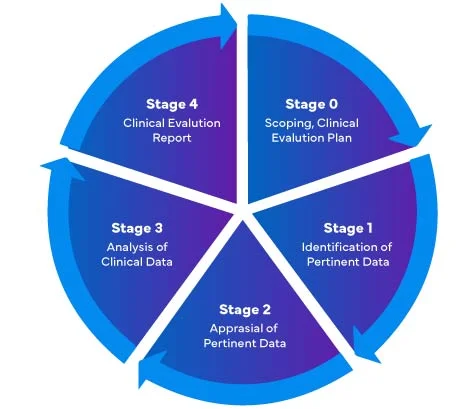
Producenci wyrobów medycznych wchodzący na rynek UE po raz pierwszy muszą upewnić się, że ich raport oceny klinicznej jest zgodny z EU MDR przepisami EU MDR .
Freyr end-to-end usługi certyfikacji end-to-end dla producentów urządzeń, w tym sporządzanie raportów z oceny klinicznej zgodnie z nowo wdrożonymi przepisami EU MDR . Dzięki bogatej wiedzy wyroby medyczne w UE, Freyr wymagania poszczególnych agencji i odpowiednio dostosowuje raporty z oceny klinicznej.
Clinical evaluation report (CER)
- End-to-end wsparcie w zakresie sporządzania raportów z oceny End-to-end , w tym wyszukiwanie literatury, zgodnie z MEDDEV 2.7/1 wersja 4 i wytycznymi unijnego rozporządzenia w sprawie wyrobów medycznych (MDR).
- Opracowanie planu oceny klinicznej dla organizacji.
- Zidentyfikować, wyszukać, przeanalizować i zestawić odpowiednią literaturę naukową.
- Opracuj szablon raportu oceny klinicznej dla swojej organizacji.
- Analiza luk w istniejącym raporcie z oceny klinicznej.
- Narzędzie DMS umożliwiające zespołowi wspólne tworzenie raportów z oceny klinicznej.
- Integracja danych PMS.
- Opracuj standardową procedurę operacyjną dla swojego zespołu, aby kompilować dane PMS w celu aktualizacji Raportów Oceny Klinicznej.
- Obsługa okresowych aktualizacji istniejących raportów oceny klinicznej, zgodnie z wytycznymi UE MDR.
- Obsługa danych PMS dla istniejących na rynku urządzeń.
- Zgodność z oznakowaniem CE i usługi oznakowania CE.

- Zapewnienie zgodności z najnowszymi obowiązującymi przepisami.
- Zespół wykwalifikowanych ekspertów klinicznych.
- Wielofunkcyjny wkład ekspertów ds. urządzeń medycznych w celu spełnienia wymagań.
- Pełny zakres usług od zgodności, przeglądu i planowania.





