Przegląd produktów łączonych dla urządzeń medycznych
W dynamicznym świecie opieki zdrowotnej i innowacji produkty będące połączeniem urządzeń medycznych stały się solidnym pomostem łączącym farmaceutyki, wyroby medyczne i produkty biologiczne. Rynek produktów złożonych rozwija się w szybkim tempie, a przewidywana średnia roczna stopa wzrostu (CAGR) w latach 2023–2030 wynosi 8,9%. Sektor produktów złożonych, łączących leki i urządzenia medyczne, ma przed sobą perspektywę trwałego wzrostu, wspieranego przez postęp technologiczny, ulepszoną infrastrukturę opieki zdrowotnej, płynniejsze procedury regulacyjne, strategiczną współpracę i zaangażowanie w opiekę skoncentrowaną na pacjencie.
Różne rodzaje produktów łączonych
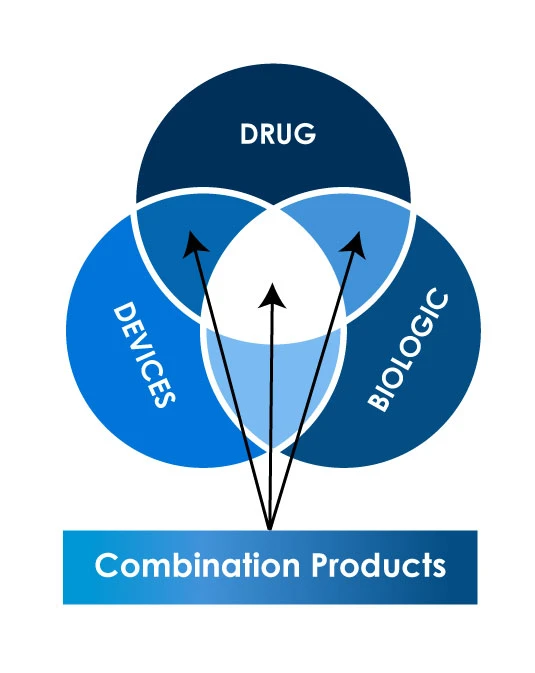
Globalny scenariusz regulacyjny dotyczący rejestracji produktów łączonych
Interpretacja tego, co stanowi produkt skojarzony, może różnić się w zależności od kraju, co dodatkowo komplikuje proces rejestracji takich produktów w różnych krajach. Ponadto wymogi i procedury regulacyjne dotyczące produktów łączonych mogą wykazywać różnice w zakresie dokumentacji, komunikacji i walidacji. Krajobraz regulacyjny dotyczący rejestracji produktów skojarzonych może się znacznie różnić na całym świecie. Oto kluczowe organy regulacyjne, które globalnie nadzorują te urządzenia.
| Kraj | Agencja | Centra wiodące do zatwierdzenia |
|---|---|---|
| USA | Biuro Produktów Łączonych (OCP) | Centrum Oceny i Badań nad Lekami (CDER) |
| Centrum Oceny i Badań Biologicznych (CBER) | ||
| Centrum Urządzeń i Zdrowia Radiologicznego (CDRH) | ||
| UE | Jednostki notyfikowane (NB) | Krajowy właściwy organ (Produkty lecznicze) |
| Jednostki notyfikowane (NB) (wyroby medyczne) | ||
| Japonia | Wydział Oceny i Licencjonowania lub Biuro Wyrobów Medycznych/Produktów Komórkowych i Tkankowych Biura Bezpieczeństwa Farmaceutycznego i Żywności | Dyrektor Działu Oceny i Licencjonowania (DMDL), Biuro Bezpieczeństwa Farmaceutycznego i Żywności, Biuro Bezpieczeństwa Farmaceutycznego i Medycznego, Ministerstwo Zdrowia i Opieki Społecznej |
| Chiny | Centrum Administracji Standaryzacji Urządzeń Medycznych (CMDSA) | Centrum Oceny Wyrobów Medycznych (CMDE) |
| Centrum Oceny Leków (CDE) | ||
| Malezja | Krajowa Agencja Nadzoru Farmaceutycznego | Krajowa Agencja Nadzoru FarmaceutycznegoNPRA) |
| Agencja ds. wyrobów medycznych |
Rejestracja produktów skojarzonych na rynkach międzynarodowych wymaga indywidualnego podejścia, obejmującego ścisłą współpracę z odpowiednimi agencjami ds. zdrowia w celu uzyskania zatwierdzenia. Typowy proces rejestracji produktu skojarzonego obejmuje następujące etapy:
- Ocena, czy określone urządzenie spełnia kryteria klasyfikacji jako produkt złożony.
- Kategoryzacja urządzeń na podstawie powiązanych zagrożeń.
- Identyfikacja odpowiednich standardów i wymogów dotyczących danych określonych przez odpowiednią agencję zdrowia.
- Generowanie niezbędnych danych zgodnie z wymogami Agencji.
- Skompilowanie dokumentacji technicznej zgodnie ze specyficznymi wymaganiami każdego kraju.
- Złożenie wniosku i odpowiadanie na wszelkie pytania lub wątpliwości do momentu uzyskania zatwierdzenia.
- Zarządzanie cyklem życia urządzenia po jego zatwierdzeniu.
Nasze kompetencje
- Wstępna analiza ryzyka
- Badania rynkowe - Wgląd w rynek specyficzny dla produktu
- Zwiększenie liczby pracowników
- Projekt strategii regulacyjnej
- Potencjalne rynki i trasy
- Dokumentacja projektowa i analiza ryzyka
- Quality Management System (QMS) ISO 13485
- Medical Device Single Audit Program MDSAP)
- Wstępna ocena systemu zarządzania jakością ISO 13485
- Strategia regulacyjna
- Freyr IMPACT (platforma analityki regulacyjnej)
- Weryfikacja i walidacja projektu
- Zarządzanie ryzykiem
- Projekt dokumentacji technicznej
- Strategia regulacyjna
- Wymogi regulacyjne
- Narzędzie Freyr rDMS (system zarządzania danymi/dokumentacją)
- Walidacja procesowa i kliniczna
- Ostateczne etykietowanie i artwork
- Reprezentacja w kraju
- Zgłoszenie regulacyjne
- Oznaczenie "Conformité Européenne" (CE) Unii Europejskiej (UE) i oznaczenie "UK Conformity Assessment" (UKCA).
- Certyfikacja dostępu do rynku globalnego
- Wsparcie audytu jednostki notyfikowanej (NB)/jednostki zatwierdzonej
- Reprezentacja w kraju
- Zatwierdzenia regulacyjne
- Post-market Surveillance (PMS)
- Obserwacja kliniczna po wprowadzeniu do obrotu (PMCF)
- Coroczne prowadzenie dokumentacji technicznej (CER/Zarządzanie ryzykiem)
- Odnowienia regulacyjne
- Wprowadzanie nowych produktów na rynek
- Komunikacja z właściwym organem/jednostką notyfikowaną/zatwierdzoną
- Automated monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny PV) solutions
Dlaczego Freyr?
Rejestracja urządzeń medycznych
- Kompleksowa strategia regulacyjna dla produktu łączonego.
- Wsparcie regulacyjne dla dokumentów rozwoju produktu, takich jak pliki historii projektu (DHF).
- Strategia zgodności z QMS.
- Zgodność z przepisami, analiza luk i naprawa dokumentów technicznych i systemów jakości.
- Usługi etykietowania regulacyjnego i pisania tekstów technicznych.
- Usługi w zakresie analizy regulacyjnej i rynkowej.
- Usługi tłumaczenia dokumentów i etykiet.
- Współpraca i obsługa agencji zdrowia.
- artwork regulacyjnej.
- monitorowanie bezpieczeństwa stosowania produktów leczniczych nigdy nie tłumacz jako system fotowoltaiczny usługi PMS.
- Usługi wydawnicze.
- Usługi pisania tekstów medycznych.

- Pomyślne zgłoszenia dla różnych klas IVD.
- Dedykowany i doświadczony personel zapewniający wsparcie regulacyjne w zakresie wyrobów medycznych i IVD.
- Terminowe dostarczanie rezultatów.
- Lokalny dostęp partnerski, aby sprostać wyzwaniom Urzędu i wymaganiom specyficznym dla danego języka.
- Wsparcie przedstawiciela krajowego lub prawnego w opłacalnym modelu.
- Zarządzanie zasobami regulacyjnymi / usługi zwiększania personelu.





