Usługi etykietowania klinicznego - przegląd
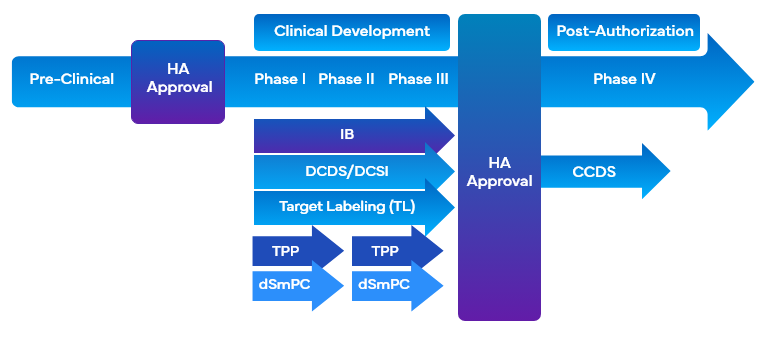
Podczas opracowywania leków firmy wykorzystują różne narzędzia związane z etykietowaniem klinicznym, które wykorzystują etykietowanie docelowe w celu ułatwienia opracowywania leków. Narzędzia te jednocześnie dostosowują pożądane cele marketingowe i cele etykietowania badań klinicznych do projektu programu rozwoju lub projektu badania i ułatwiają sporządzenie przeglądu klinicznegoCO). Niektóre z narzędzi etykietowania klinicznego, które wykorzystują etykietowanie docelowe podczas opracowywania leków to:
- Broszura dla badaczyIB)
- Znakowanie celuTL)/profil celu
- Arkusz podstawowych danych programistycznychDCDS)
- Opracowanie podstawowych informacji dotyczących bezpieczeństwaDCSI)
- Docelowy profil produktu FDA TPP)
Ważne jest, aby firmy stosowały podejście modułowe podczas gromadzenia informacji o bezpieczeństwie i skuteczności w kilku rodzajach etykiet klinicznych w celu uzupełnienia wymagań dotyczących etykiet klinicznych. Zaspokoiłoby to potrzebę skutecznej pomocy badaczom i sponsorom poprzez prezentację i aktualizację ukierunkowanej i dedykowanej sekcji DCSI , którą można wygodnie umieścić w różnych kategoriach klinicznych.
Co więcej, DCSI jest zawarte w podstawowych informacjach o bezpieczeństwie firmyCCSI), które stanowią podstawę pierwszego podstawowego arkusza danych firmyCCDS) i są wykorzystywane do wprowadzenia produktu na rynek. Sporządzenie dogłębnego CO obejmującego zakres i krytyczne kwestie w programie rozwoju klinicznego leku jest również wymagane w celu wsparcia dokumentacji dla oceniających.
Usługi etykietowania klinicznego Freyr
Usługi etykietowania klinicznego
- Tworzenie i przegląd broszury badawczejIB)
Freyr ma duże doświadczenie w tworzeniu, pisaniu i recenzowaniu IB dla różnych programów klinicznych naszych klientów. IB są najbardziej zaawansowanymi formami etykiet, których celem jest dostarczenie badaczowi lub lekarzowi prowadzącemu leczenie istotnych informacji dotyczących leku/interwencji. Ich celem jest dostarczenie badaczom i innym osobom zaangażowanym w badanie niezbędnych informacji, aby ułatwić im zrozumienie uzasadnienia i zgodność z wieloma kluczowymi cechami protokołu. Obejmują one dawkę, częstotliwość/przerwy w dawkowaniu, metody podawania i procedury monitorowania bezpieczeństwa. IB zawiera informacje przedkliniczne i kliniczne związane z badanym lekiem.

Podczas pracy nad IB eksperci Freyrds. etykietowania klinicznego przedstawiają informacje w zwięzłej, prostej, obiektywnej i zrównoważonej formie. Te same cechy można również uwzględnić podczas tłumaczenia dokumentów. Oprócz tworzenia IB, Freyr wspiera również coroczny przegląd IB i w razie potrzeby pracuje nad zmianami, zgodnie ze standardowymi procedurami ustanowionymi przez klientów i sponsorów.
- Opracowanie oznakowania celuTL)/profilu celu
- Rozwój i przegląd DCDS i DCSI
Freyr posiada udokumentowane doświadczenie w tworzeniu wysokiej jakości Developmental Core Data SheetsDCDS). DCDS jest pośrednią etykietą podstawową niezbędną do uzyskania treści dla krajowych etykiet first-to-file (takich jak USPI, SmPC itp.). DCSI jest przygotowywany na podstawie etykiety docelowej i zapewnia zintegrowane bezpieczeństwo i skuteczność interwencji lub leku. DCSI pomaga badaczom i sponsorom, prezentując i aktualizując ukierunkowane i dedykowane sekcje DCDS , które można wygodnie umieścić w IB. DCSI ułatwia opracowanie CCSI, które później stanowi integralną część podstawowego arkusza danych firmyCCDS).
- Opracowanie i przegląd docelowego profilu produktu FDA TPP) i projektu SmPC UE (dSmPC)
Profil docelowego produktu (TPP)/projekt charakterystyki produktu leczniczego (dSmPC) to forma etykiety klinicznej, która ułatwia rozmowy między firmami farmaceutycznymi a organami ds. zdrowia. TPP jest stosowany w całym procesie opracowywania leku, od fazy przed złożeniem wniosku o dopuszczenie nowego leku do badań klinicznych (IND) i fazy składania wniosku o dopuszczenie nowego leku do badań klinicznych (IND), poprzez programy po wprowadzeniu leku do obrotu, w celu uzyskania nowych wskazań lub innych istotnych zmian w oznakowaniu badań klinicznych. Firmy farmaceutyczne określają koncepcje etykietowania, które są celami programu opracowywania leków, w formie TPP. TPP zawiera oświadczenie dotyczące ogólnego celu programu opracowywania leków oraz informacje o leku na konkretnym etapie rozwoju. Jako strategiczny partner regulacyjny, Freyr posiada doświadczenie w przygotowywaniu TPP dla US dSmPc dla Unii Europejskiej.
- Zasoby z dogłębną wiedzą regulacyjną w zakresie opakowań klinicznych i etykietowania
- Doświadczenie w skutecznej obsłudze globalnego i regionalnego etykietowania leków dla klientów farmaceutycznych Fortune w USA, Europie, APAC, MENA itp.
- Globalna ekspertyza regulacyjna w zakresie pomocy organizacjom z branży nauk przyrodniczych, a mianowicie firmom farmaceutycznym, biotechnologicznym i producentom odżywek.
- Wysoko wykwalifikowani pisarze medyczni posiadający rozległe doświadczenie w zakresie etykietowania regulacyjnego
- Dogłębne i aktualne zrozumienie globalnych zmian w etykietowaniu leków wprowadzanych przez różne organy ds. zdrowia, takie jak USFDA, EMA, TGA itp.
- Dedykowany zespół ds. zgodności śledzi stan wdrożenia podstawowych i firmowych arkuszy danychCDSCCDS) w regionalnych etykietach.
- Doświadczenie w zakresie etykietowania badań klinicznych i usług etykietowania klinicznego
- Wysoce doświadczeni specjaliści w zakresie etykietowania produktów farmaceutycznych, biotechnologicznych i żywieniowych





