Przegląd Software as a Medical Device SaMD)
Software as a Medical Device SaMD) to najnowszy, dynamicznie rozwijający się temat w segmencie opieki zdrowotnej. Oczekuje się, że rynek SaMD będzie rósł w tempie 10,78% w skali globalnej. Wzrost ten jest spowodowany różnymi czynnikami, takimi jak przyjęcie Internetu rzeczy (IoT), cyfrowych platform opieki zdrowotnej oraz przyjęcie oprogramowania do ciągłego monitorowania parametrów fizjologicznych przez świadczeniodawców opieki zdrowotnej w celu zdalnej pomocy. Jednak ten obiecujący krajobraz wiąże się również z wyjątkowymi wyzwaniami, z których jednym jest ustalenie, czy należy on do kategorii urządzeń medycznych i spełnia wymogi regulacyjne.
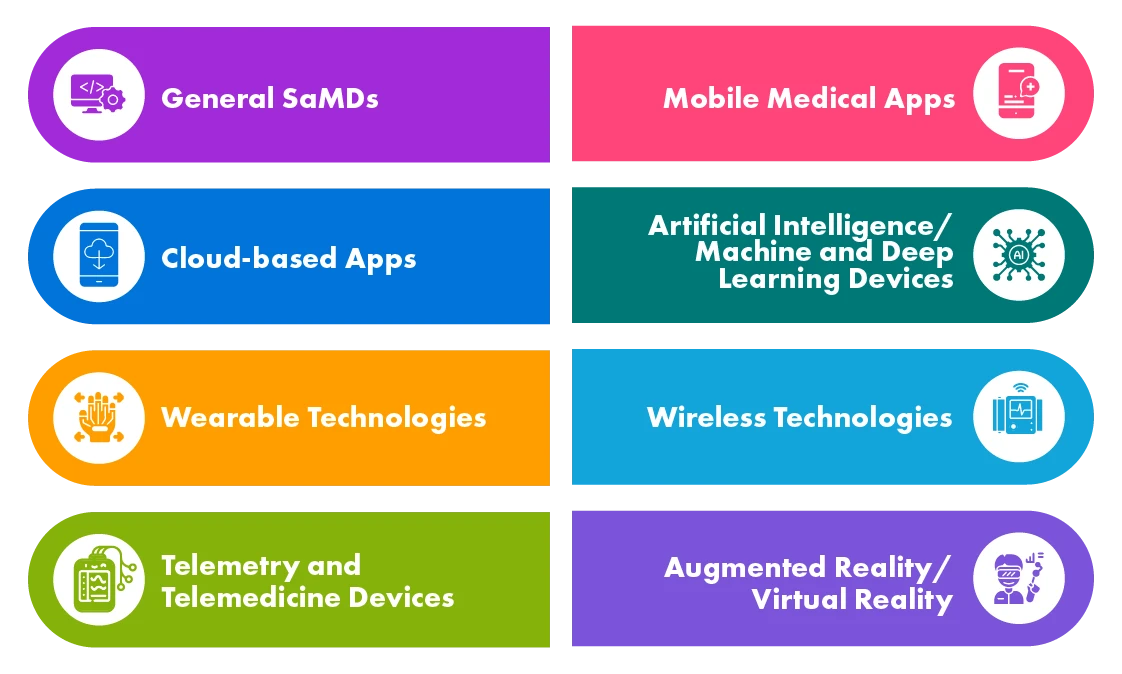
Różne rodzaje cyfrowych produktów zdrowotnych
Globalny scenariusz regulacyjny dotyczący rejestracji Software as a Medical Device SaMD)
SaMD są wykorzystywane w różnych zastosowaniach, takich jak badania przesiewowe i diagnostyka, monitorowanie i ostrzeganie, zarządzanie chorobami itp. Agencje zdrowia w krajach rozwiniętych, takich jak UE, US, Kanada i Australia, określiły przepisy dotyczące SaMD, a niektóre z nich opracowały już wytyczne, podczas gdy inne są w trakcie tego procesu.
Niektóre rynki regulowane i nieregulowane traktują oprogramowanie jako wyroby medyczne nie posiadają zróżnicowanych i szczegółowych wytycznych dotyczących klasyfikacji Software as a Medical Device SaMD). Stosują one międzynarodowe, zharmonizowane wytyczne dotyczące oceny i zatwierdzania oprogramowania.
Poniżej wymieniono niektóre z najważniejszych wytycznych dotyczących rejestracji Software as a Medical Device SaMD):
- Wytyczne IMDRF dotyczące klasyfikacji, Quality Management System (QMS), oceny cyberbezpieczeństwa i oceny klinicznej.
- Rozporządzenie EU MDR 2017/745 szczegółowo określa wymogi regulacyjne i wytyczne dla tej kategorii urządzeń.
- Wytyczne MDCG dotyczące kwalifikacji i klasyfikacji SaMD, wymagania dotyczące Clinical Evaluation Reports (CER)/raportów oceny wydajności (PER) dla SaMD.
- FDA US FDA dotyczące cyberbezpieczeństwa, oceny klinicznej i wymogów rejestracyjnych dla różnych rodzajów oprogramowania, takich jak systemy decyzyjne, systemy archiwizacji i komunikacji obrazów (PACS), aplikacje mobilne itp.
- Wytyczne Health Canada dotyczące definicji i klasyfikacji SaMD .
- Nowe przepisy TGA dotyczące wyroby medyczne opartych na oprogramowaniu.
Rejestracja SaMD na innych światowych rynkach jest rozpatrywana indywidualnie i wymaga ścisłej współpracy z odpowiednią Agencją Zdrowia w celu jej zatwierdzenia. Ogólna ścieżka rejestracji SaMD obejmuje:
- Ustalenie, czy dane oprogramowanie kwalifikuje się jako SaMD.
- Klasyfikacja urządzeń na podstawie związanego z nimi ryzyka.
- Określenie obowiązujących norm i wymogów dotyczących danych przez daną agencję ds. zdrowia.
- Generowanie danych wymaganych przez odpowiednią agencję.
- Kompilacja dokumentacji technicznej zgodnie z wymaganiami danego kraju.
- Składanie i rozwiązywanie zapytań do momentu zatwierdzenia.
- Zarządzanie cyklem życia po zatwierdzeniu.
Nasze kompetencje
- Regulatory Intelligence Services (związane z rynkiem i wsparciem w zakresie etykietowania)
- Należyta staranność regulacyjna / raporty strategiczne
- Kwalifikacja i klasyfikacja SaMD
- Klasyfikacja produktu Zastosowanie do NB
- Analiza luk
- Spotkania z FDA poprzedzające złożenie wniosku
- Identyfikacja obowiązujących norm
- Działania związane z zarządzaniem ryzykiem
- Wsparcie zarządzania ryzykiem
- Wsparcie etykietowania
- Tworzenie/przegląd/aktualizacja procedur/szablonów właściwych SaMD
- UDI/GUDID
- Rejestracja produktu (rejestracja oprogramowania)
- Rejestracja zakładu
- Lista urządzeń
- HA Odpowiedź na zapytanie - usługi SaMD
Dlaczego Freyr?
Często zadawane pytania (FAQ)
Regulacje dotyczące oprogramowania medycznego są nadzorowane przez różne globalne organy regulacyjne, w tym FDA w Stanach Zjednoczonych, EMA w Europie i PMDA w Japonii. Agencje te klasyfikują oprogramowanie medyczne w oparciu o ryzyko i ustanawiają wytyczne dotyczące bezpieczeństwa, jakości i skuteczności. Wymagana jest zgodność z normami ISO, takimi jak ISO 13485 i 62304.
Określenie klasyfikacji ryzyka Software as a Medical Device SaMD) obejmuje ocenę takich czynników, jak zamierzone zastosowanie i potencjalne szkody. SaMD są klasyfikowane podobnie jak tradycyjne urządzenia medyczne w oparciu o znaczenie informacji dostarczanych do decyzji dotyczących opieki zdrowotnej oraz stan sytuacji lub stanu opieki zdrowotnej jako niepoważny, poważny i krytyczny. Wytyczne regulacyjne i konsultacje ekspertów mają kluczowe znaczenie w tym procesie, zapewniając zgodność i bezpieczeństwo pacjentów.
SaMD odnosi się do oprogramowania, które ma być wykorzystywane do jednego lub więcej celów medycznych, nie będąc częścią fizycznego urządzenia medycznego. Działa ono na platformach obliczeniowych ogólnego przeznaczenia, takich jak smartfony, tablety lub komputery osobiste. Z drugiej strony, SiMD to oprogramowanie, które jest integralną częścią fizycznego urządzenia medycznego, przyczyniając się do jego funkcjonalności i wydajności. SiMD nie może być używane niezależnie i polega na powiązanym urządzeniu medycznym, aby wykonać zamierzony cel.
Oprogramowanie, które jest wbudowane jako część sprzętowego wyrobu medycznego i jest niezbędne do realizacji zamierzonego celu medycznego, NIE JEST uważane za SaMD.
Harmonogram osiągnięcia zgodności z SaMD zależy od klasy ryzyka i wymogów regulacyjnych. Jednak dzięki odpowiedniej pomocy ze strony organów regulacyjnych można zapewnić płynniejszy proces zapewniania zgodności przy minimalnym ryzyku.
Rejestracja urządzeń medycznych
- Kompleksowa strategia regulacyjna dla SaMD.
- Wsparcie w zakresie informacji regulacyjnych i rynkowych.
- Usługi klasyfikacji i rejestracji produktów dla SaMD.
- Wsparcie regulacyjne dla dokumentów rozwojowych produktów SaMD .
- Usługi konsultacyjne w zakresie badań oceny klinicznej SaMD .
- Zarządzanie zmianami po zatwierdzeniu.
- Usługa reprezentacji lokalnej.

- Kompleksowa strategia regulacyjna dla SaMD.
- Wsparcie w zakresie informacji regulacyjnych i rynkowych.
- Usługi klasyfikacji i rejestracji produktów dla SaMD.
- Wsparcie regulacyjne dla dokumentów rozwojowych produktów SaMD .
- Usługi konsultacyjne w zakresie badań oceny klinicznej SaMD .
- Zarządzanie zmianami po zatwierdzeniu.
- Usługa reprezentacji lokalnej.





