Przegląd programu FDA eSTAR
Inicjatywa FDA została opracowana w celu zwiększenia wydajności i jednolitości w przygotowywaniu i ocenie wniosków FDA (k) i De Novo. W oparciu o początkowe podejście eSubmitter, które obejmowało elektroniczne składanie wniosków dotyczących wyroby medyczne IVD, powstał program eSTAR, oparty na wcześniejszych doświadczeniach FDA. FDA innego programu o nazwie Electronic Submission Template and Resource (eSTAR) Pilot Program. Od 1 października 2023 r. wnioski 510(k) (tradycyjne, skrócone lub specjalne 510[k]) będą musiały być składane za pomocą programu eSTAR. Szablony są dostępne online, ale do faktycznego złożenia wniosku konieczne jest posiadanie danych logowania do FDA .
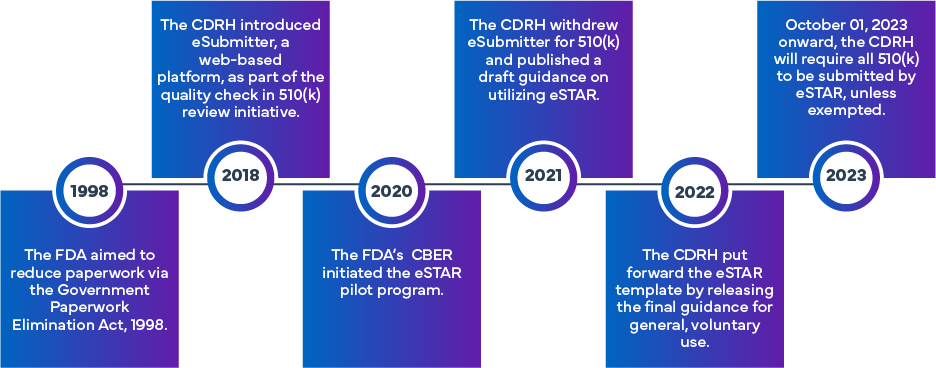
Co to jest FDA eSTAR?
eSTAR to interaktywny szablon PDF, który ma ułatwić przygotowanie kompleksowego wniosku o dopuszczenie wyrobu medycznego do obrotu w ramach procesu zatwierdzania 510(k) FDAw US. Ponadto wnioskodawcy mogą wykorzystać eSTAR do przedkładania odpowiedzi na prośby FDAo dodatkowe informacje. Jego celem jest poprawa jakości wniosków dotyczących różnych wyroby medyczne zapewnienie, że wnioskodawcy dostarczają kompletne i wysokiej jakości dane do oceny przed wprowadzeniem na rynek FDA.
Dzięki przyjęciu formatu eSTAR osoby składające wnioski mogą mieć pewność co do kompletności swoich zgłoszeń, co z kolei umożliwi FDA bardziej efektywne FDA przeglądów przed wprowadzeniem produktu na rynek i zapewni terminowy dostęp do bezpiecznych i skutecznych wyroby medyczne. Szablon eSTAR jest dostępny bezpłatnie i może być dobrowolnie stosowany przez wszystkie podmioty składające wnioski dotyczące wyrobów medycznych do FDA w ramach procedur 510(k), De Novo i Q. Istnieją dwa rodzaje szablonów eSTAR – jeden dla wyroby medyczne drugi dla wyrobów medycznych do diagnostyki in vitro (IVD). W dniu 9 czerwca 2023 r. FDA wersję beta eSTAR (PreSTAR) do przedkładania wniosków wstępnych (rodzaj wniosków Q).
Charakterystyka i ograniczenia zgłoszeń eSTAR
Chociaż program eSTAR oferuje interaktywny formularz PDF zaprojektowany, aby pomóc wnioskodawcom w przygotowaniu dokładnych zgłoszeń wyrobów medycznych i IVD, ma on zarówno zalety, jak i wady. Wnioskodawcy muszą rozumieć te zalety i ograniczenia, aby móc dokonywać świadomych wyborów dotyczących włączenia programu eSTAR do procesu składania wniosków. W poniższej tabeli przeanalizujemy atrybuty i ograniczenia programu eSTAR.

Uwagi dotyczące efektywnego korzystania z eSTAR
Korzystną cechą szablonu eSTAR, która przyczynia się do optymalizacji procesu składania wniosków, jest automatyczne włączanie odpowiednich przepisów i uznanych standardów do cytowania. Nie tylko przyspiesza to proces składania wniosków poprzez ograniczenie ręcznego wprowadzania danych, ale także ogranicza możliwość wystąpienia błędów ludzkich, które mogą wystąpić podczas wprowadzania przepisów i norm. Dzięki kierowanej konstrukcji dla każdej sekcji składania wniosków, wykorzystanie eSTAR w procesie składania wniosków można bez wysiłku usprawnić.
- FDA sugeruje Adobe Acrobat Pro lub Foxit PDF Editor do edycji szablonów eSTAR.
- eSTAR zawiera pewne zintegrowane formularze, eliminując w ten sposób potrzebę ich oddzielnego wypełniania. Obejmują one formularz 3514 (arkusz tytułowy zgłoszenia) i formularz 3881 (wskazania użytkowania). Dodatkowo, zgodne z prawdą i dokładne oświadczenie, które wcześniej było wymagane na papierze firmowym, jest teraz zintegrowane z eSTAR.
- eSTAR obsługuje różne formaty załączników, nie tylko pliki PDF, takie jak arkusze kalkulacyjne Excel i pliki wideo (mp4).
- Pliki w formatach obsługujących makra i wykonywalnych są niedozwolone.
- Całkowity rozmiar pliku eSTAR PDF wraz z załącznikami nie może przekraczać 1 GB, ponieważ pliki większe niż 4 GB nie będą akceptowane.
- Jeśli pliki elektroniczne przekraczają limity techniczne, można wysłać zgłoszenie cyfrowe do Centrum Kontroli Dokumentów CDRH (DCC) pocztą.
Najlepsze praktyki dotyczące przygotowywania zgłoszeń eSTAR
Przestrzeganie niektórych najlepszych praktyk w zakresie przygotowywania zgłoszeń eSTAR może pomóc wnioskodawcom usprawnić proces składania wniosków i zwiększyć ich szanse na pomyślny wynik. Oto kilka najlepszych praktyk:
- Przestrzeganie wytycznych FDA : FDA oferuje wytyczne pomagające wnioskodawcom w skutecznym korzystaniu z szablonu eSTAR. Przestrzeganie tych wskazówek zapewnia zgodność zgłoszeń z wymaganiami i oczekiwaniami FDA.
- Zapewnienie kompletności: Szablon eSTAR prowadzi wnioskodawców przez niezbędne informacje. Wnioskodawcy muszą podać wszystkie wymagane szczegóły, aby zminimalizować ryzyko wystąpienia braków lub prośby o dodatkowe informacje.
- Zachowanie spójności: Szablon eSTAR zapewnia jednolitość treści i struktury zgłoszeń 510(k). Konstrukcja każdej sekcji zgłoszenia pomaga wyodrębnić informacje na temat urządzenia medycznego.
- Priorytetem jest przejrzystość: w zgłoszeniach eSTAR należy podawać jasne i zwięzłe informacje, aby usprawnić proces weryfikacji. Takie szczegółowe i precyzyjne informacje minimalizują opóźnienia i błędy, a także zapewniają terminowy dostęp do zgłoszeń przed wprowadzeniem wyroby medyczne do obrotu.
- Bezpieczna precyzja: Automatyczna weryfikacja informacji w każdej sekcji zgłoszeń eSTAR pomaga ograniczyć opóźnienia w weryfikacji i potencjalne braki.
Znaczenie kodowania kolorami w zgłoszeniu FDA eSTAR
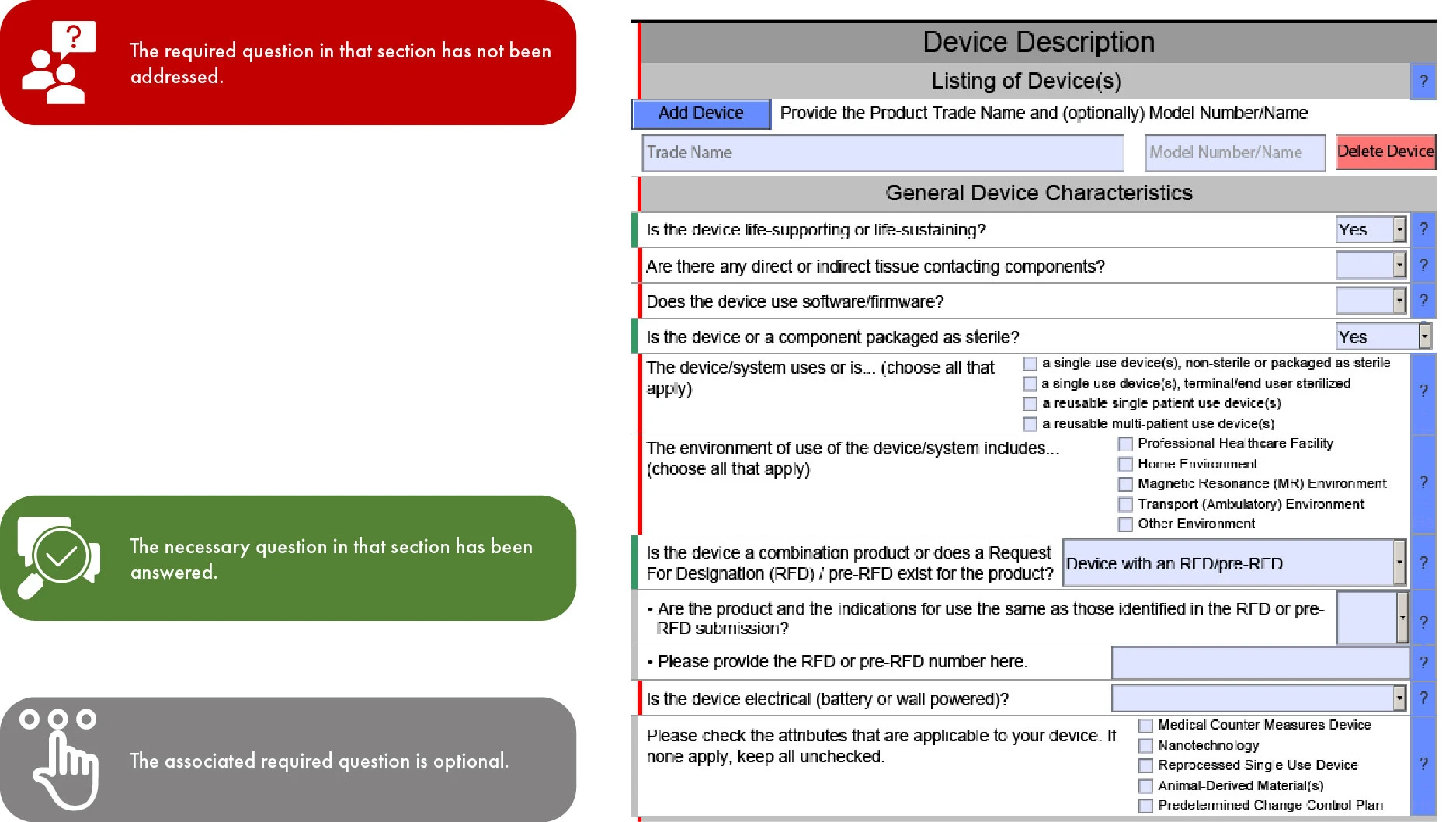
Ponieważ od 1 października 2023 r. system eSTAR stanie się obowiązkowy dla wniosków 510(k), a dla wniosków De Novo będzie dobrowolny, kolejność sekcji w szablonie zależy od rodzaju wniosku. Takie uproszczenie ułatwia szybszą ocenę przez US agencjęFDA, minimalizując tym samym niespójności i pominięcia we wniosku. Należy jednak pamiętać, że FDA opóźnić ocenę, jeśli brakuje angielskich tłumaczeń dostarczonej dokumentacji.

Wyrównaj swoje załączniki
Należy wcześniej zapoznać się z szablonem eSTAR, aby zrozumieć sposób podziału załączników i upewnić się, że dokumenty są zgodne z sekcjami załączników. Ten krok ma kluczowe znaczenie, szczególnie dla firm, które wcześniej złożyły 510(k), ponieważ istniejące podejście do organizacji dokumentów może wymagać korekt. Może to również obejmować wyodrębnianie treści z załączników.
- eSTAR wymaga zwięzłych załączników, które różnią się od tradycyjnych zgłoszeń.
- Spodziewaj się licznych załączników, potencjalnie dziesiątek.
- Załączniki umożliwiają dołączanie danych, takich jak arkusze kalkulacyjne Excel, pliki wideo MP4, dokumenty Word, pliki JPEG itp.
- eSTAR chce numerów stron dla informacji o załącznikach, ale nie sugeruje korzystania z listy kontrolnej odmowy akceptacji dla wytycznych FDA .
Szablony: Szablony są dostępne pod podanym linkiem: https:fda
Przyszłość eSTAR
Przewiduje się, że eSTAR zostanie zaktualizowany po sfinalizowaniu kompleksowych wytycznych dotyczących stosowania. Dzięki tym aktualizacjom producent będzie mógł odwoływać się do najnowszych wersji wydanych przez US agencjęFDA.
Health Canada (HC) wprowadziła pilotażową inicjatywę stosowania systemu eSTAR dla urządzeń klasy III i IV. Istnieje przypuszczenie, że inne kraje mogą naśladować Kanadę w zakresie uznaniowego przyjęcia eSTAR, szczególnie w ramach konsorcjum IMDRF. Należy jednak zauważyć, że nie było żadnych wyraźnych deklaracji w tym zakresie.
Dlaczego warto wybrać Freyr?
Freyr może pochwalić się bogatą wiedzą specjalistyczną zdobytą dzięki zaangażowaniu w liczne projekty skoncentrowane na składaniu wniosków do FDA w przeszłości. Przedstawiając podwójne ścieżki proaktywnego wspierania branży w przyspieszaniu zgłoszeń 510(k) i De Novo, Freyr zapewnia szereg usług dla klientów, które obejmują kompleksową listę niezbędnych dokumentów zgłoszeniowych i wymaganych informacji, przeprowadzanie drobiazgowych analiz luk w dokumentacji, kompilowanie zgłoszeń za pośrednictwem eSTAR i finalizowanie pakietu zgłoszeń przed wprowadzeniem na rynek do FDA. Ponadto Freyr rozszerza swoje wsparcie na działania po złożeniu wniosku, takie jak dostarczanie dodatkowych informacji i przeglądanie odpowiedzi branży na wszelkie wnioski o informacje uzupełniające złożone przez FDA.
Jak Freyr może pomóc?
Freyr oferuje wsparcie, które może być pomocne w przygotowaniu się do zgłoszeń 510(k) i De Novo. Usługi te obejmują:
- Wsparcie ścieżki regulacyjnej: Obejmuje to identyfikację kodu produktu, nazwy i numeru rozporządzenia, potencjalnych urządzeń referencyjnych, testów wydajności, a także obowiązujących norm i dokumentów zawierających wytyczne dotyczące danego urządzenia.
- Wsparcie przy składaniu zapytań (zgłoszenia wstępne): Obejmuje to pomoc w wyjaśnianiu zapytań związanych z warunkami wstępnymi zgłoszenia przed wprowadzeniem na rynek, organizacją zgłoszenia, przygotowaniem się do spotkania z FDA , interaktywną współpracą z FDA podczas spotkania oraz sporządzeniem protokołu ze spotkania.
Wiedza specjalistyczna programu eSTAR FDA
- Kompleksowa strategia regulacyjna FDA .
- Identyfikacja urządzenia predykatu.
- Ustalenie istotnej równoważności z urządzeniem źródłowym.
- Analiza luk pod kątem zgodności z przepisami FDA .
- Kompilacja dwudziestu jeden (21) sekcji dokumentacji technicznej 510(k).
- Publikowanie i tworzenie eCopy.
- Zatwierdzenie i przesłanie eKopii.
- Współpraca z usługami w celu zatwierdzenia urządzenia.
- Adresowanie odpowiedzi i niedociągnięć RTA.
- Usługi konsultacyjne w zakresie usuwania niedociągnięć.
- Lista urządzeń i obsługa bazy danych FURLS.