SaMD w Stanach US przegląd
Odpowiedzi na tej stronie
- Czy moje oprogramowanie jest SaMD?
- Która klasa ryzyka SaMD wymaga zgłoszenia 510(k)?
- Rejestracja i zgodność z SaMD - proces 510(k)
- Jak długo ważne jest zezwolenie?
Czy moje oprogramowanie jest SaMD?
Według Międzynarodowego Forum Regulatorów Wyrobów Medycznych (IMDRF), SaMD to:
- Oprogramowanie przeznaczone do jednego lub więcej celów medycznych.
- Realizuje te cele, nie będąc częścią sprzętowego urządzenia medycznego.
Która klasa ryzyka SaMD wymaga zgłoszenia 510(k)?
Określenie SaMD dla oprogramowania jest ważnym krokiem w procesie rejestracji. Po sklasyfikowaniu oprogramowania jako SaMD konieczne jest zrozumienie ścieżki regulacyjnej wymaganej do wejścia na rynek US. SaMD zazwyczaj podzielone na różne klasy w zależności od poziomu ryzyka. SaMD klasy II SaMD uważane za produkt o umiarkowanym ryzyku, wymaga zezwolenia 510(k) i opiera się na udowodnieniu istotnej równoważności z legalnie wprowadzonym do obrotu urządzeniem referencyjnym. Proces udzielania zezwoleń gwarantuje, że oprogramowanie SaMD zasadniczo równoważne z istniejącymi urządzeniami, co pomaga zapewnić jego bezpieczeństwo i skuteczność przed wprowadzeniem do obrotu.
Rejestracja i zgodność z SaMD - proces 510(k)
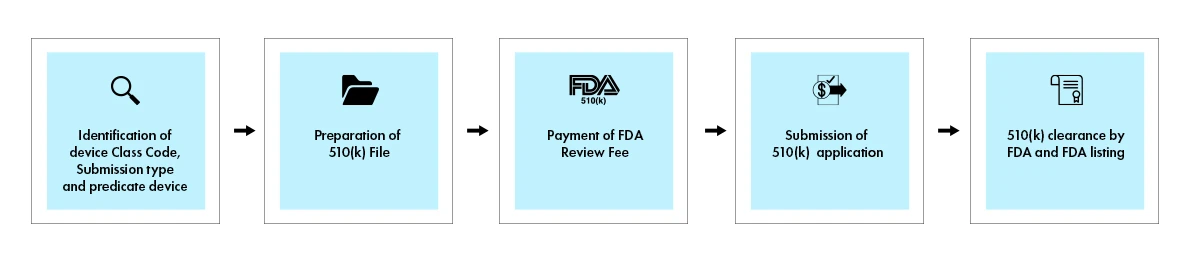
Proces 510(k) obejmuje złożenie kompleksowej dokumentacji wykazującej istotną równoważność z legalnie wprowadzonym do obrotu urządzeniem referencyjnym. Po podjęciu decyzji US Agencja US i Leków (FDA) wysyła do wnioskodawcy pismo z decyzją pocztą elektroniczną. Wniosek 510(k), który otrzyma pismo z decyzją o istotnej równoważności, uznaje się za „zatwierdzony”. Następnie jest on umieszczany w bazie danych 510(k) wraz z załączonym streszczeniem 510(k). Poniższy rysunek przedstawia wizualny przegląd kluczowych etapów procesu 510(k).
Jak długo ważne jest zezwolenie?
Zezwolenie 510(k) zachowuje ważność do momentu wprowadzenia istotnych zmian w urządzeniu lub obowiązujących przepisach. Należy jednak pamiętać, że US agencjaFDA wymagać okresowych sprawozdań lub dodatkowych informacji w celu zapewnienia ciągłej zgodności i bezpieczeństwa.
Podsumowując, rejestracja SaMD wymaga dogłębnego zrozumienia klasyfikacji SaMD , zgodności z SaMD i procesów regulacyjnych. Skorzystanie z usług konsultingowych SaMD może zapewnić fachowe wskazówki w poruszaniu się po zawiłościach i zapewnieniu pomyślnego wyniku rejestracji.
SaMD w Stanach US
- Kompleksowa strategiaFDA US FDA dotycząca oprogramowania medycznego ( SaMD).
- Klasyfikacja SaMD .
- Identyfikacja urządzenia predykatu.
- Ustalenie istotnej równoważności z urządzeniem źródłowym.
- Analiza luk w zakresieFDA US FDA .
- Opracowanie dokumentacji technicznej 510(k) zgodnie z wytycznymi US FDAdotyczącymi przedkładania wniosków przed wprowadzeniem oprogramowania na rynek.
- Utworzenie szablonu eCopy/eSTAR.
- Zatwierdzenie i przesłanie szablonu eCopy/eSTAR.
- Współpraca z usługami w celu zatwierdzenia urządzenia.
- Wsparcie dla reakcji RTA i niedociągnięć AINN.
- Usługi konsultacyjne w zakresie usuwania niedociągnięć.
- Rejestracja zakładu w US agencjiFDA.
- Lista urządzeń i obsługa bazy danych FURLS.
- Usługi przedstawiciela prawnego (LR).

- Rozległe doświadczenie z różnymi rejestracjami 510(k).
- Doświadczenie w zakresie kompilacji 510(k), zgodnie z wymogami US FDAdotyczącymi powiadomień przed wprowadzeniem produktu na rynek (510[k]).
- Dodatkowe wsparcie dla obsługi zapytań 510(k).
- Terminowe dostarczanie rezultatów.
- Na bieżąco z nowymi zmianami US FDAdotyczącymi SaMD.





