Ocena wydajności wyroby medyczne przegląd
Rynek Software as a Medical Device (SaMD ) przeżywa globalny rozkwit, biorąc pod uwagę takie czynniki, jak rosnące zapotrzebowanie na zdalne usługi zdrowotne i nadchodzące innowacje w cyfrowej przestrzeni zdrowotnej. Przewiduje się, że w Europie rynek SaMD wzrośnie o około 27,1% w latach 2021-2027.
SaMD obejmuje wyrób medyczny do diagnostyki in vitro (IVD). Należy podkreślić, że przepisy UE nie posługują się terminemSoftware as a Medical Device SaMD)". Zamiast tego używają terminu "oprogramowanie urządzenia medycznego", w skrócie MDSW.
W Unii Europejskiej (UE) wyroby medyczne są regulowane rozporządzeniem w sprawie wyrobów medycznych (MDR) 2017/745 oraz rozporządzeniem w sprawie wyrobów medycznych do diagnostyki in vitro (IVDR) 2017/746. Rozporządzenia te stanowią ramy zapewniające bezpieczeństwo i skuteczność wyroby medyczne, w tym SaMD, na rynku UE.
Jak oprogramowanie kwalifikuje się jako wyrób medyczny?
Aby ustalić, czy dane urządzenie jest uznawane za SaMD przez UE, należy ocenić, czy oprogramowanie jest przeznaczone do jednego (01) lub więcej celów medycznych bez bycia częścią sprzętowego wyrobu medycznego. Jeśli oprogramowanie działa samodzielnie, aby spełnić cel medyczny, może zostać zakwalifikowane jako SaMD.
Jednakże, jeśli ma ono służyć do sterowania sprzętowym wyrobem medycznym lub stanowi jego integralną część, nie będzie uznawane za oprogramowanie samodzielne, a zatem nie będzie zaliczane SaMD. Należy zawsze upewnić się, że produkt jest zgodny z najnowszymi przepisami i wytycznymi UE dotyczącymi wyroby medyczne.
Jak zarejestrować SaMD w UE?
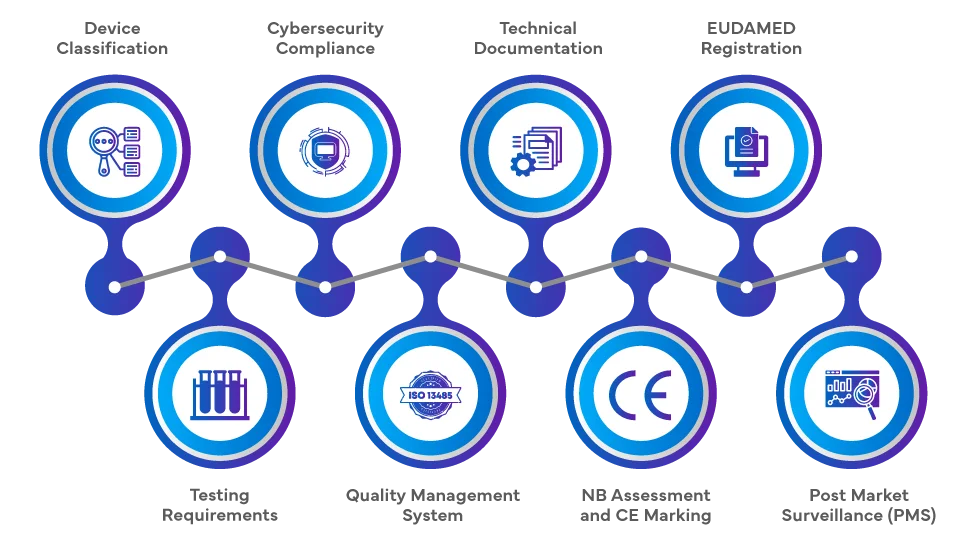
Proces regulacyjny dotyczący wprowadzania SaMD rynek UE zgodnie z rozporządzeniami EU MDR i EU IVDR 2017/746 obejmuje szereg kompleksowych kroków. Producenci muszą sklasyfikować oprogramowanie w oparciu o jego przeznaczenie i poziom ryzyka, a następnie przeprowadzić ocenę zgodności, która w przypadku klas o wyższym ryzyku może wymagać udziału jednostki notyfikowanej (NB). Kluczowe znaczenie mają dokumentacja techniczna, ocena kliniczna i zgodność z systemami zarządzania jakością (QMS). Po pomyślnej ocenie umieszcza się oznakowanie CE i konieczna jest rejestracja w europejskiej bazie danych wyroby medyczne EUDAMED). Ciągły Post-market Surveillance (PMS), czujność i przestrzeganie wymogów dotycz ących cyberbezpieczeństwa dopełniają proces regulacyjny.
Często zadawane pytania (FAQ)
Certyfikat EU MDR to dokument wydawany przez wyznaczoną jednostkę notyfikowaną w wyniku oceny zgodności zgodnie z rozporządzeniem Unii Europejskiej w sprawie wyrobów medycznych (EU MDR ) lub rozporządzeniem w sprawie wyrobów medycznych do diagnostyki in vitro (IVDR) 2017/746. Certyfikat ten potwierdza, że wyrób medyczny spełnia wymagania określone w rozporządzeniu EU MDR, które obejmują normy bezpieczeństwa, wydajności i jakości. Certyfikat jest niezbędny, aby wyroby medyczne wyroby do diagnostyki in vitro mogły być legalnie wprowadzane do obrotu w UE.
W UE wyroby medyczne podzielone na cztery (04) klasy ryzyka: klasa I, klasa IIa, klasa IIb i klasa III. Klasa I obejmuje wyroby o najniższym ryzyku, a klasa III obejmuje wyroby o najwyższym ryzyku. Klasyfikacja uwzględnia takie czynniki, jak inwazyjność wyrobu, czas użytkowania, część ciała, na którą wywiera wpływ, oraz potencjalne ryzyko związane z konstrukcją techniczną i produkcją wyrobu.
W ten sam sposób SaMD są również klasyfikowane zgodnie z ryzykiem, jakie stwarzają dla pacjentów i użytkowników, od niskiego ryzyka (klasa I) do wysokiego ryzyka (klasa III).
TerminSoftware as a Medical Device SaMD)" jest stosowany, gdy oprogramowanie jest przeznaczone do jednego (01) lub więcej celów medycznych, niezależnie wykonując te funkcje bez bycia integralną częścią sprzętowego urządzenia medycznego. Z drugiej strony, "oprogramowanie w urządzeniu medycznym (SiMD)" jest używane, gdy oprogramowanie jest zintegrowane ze sprzętem medycznym, znanym jako oprogramowanie wbudowane lub oprogramowanie układowe.
Należy podkreślić, że przepisy UE nie posługują się terminemSoftware as a Medical Device". Zamiast tego używają terminu "oprogramowanie urządzenia medycznego", w skrócie MDSW.
"Oprogramowanie wyrobu medycznego (MDSW)" odnosi się do oprogramowania przeznaczonego do użytku, samodzielnie lub w połączeniu, w celu określonym w definicji "wyrobu medycznego" zgodnie z EU MDR UE 2017/745 i IVDR UE 2017/746.
Czas potrzebny na zatwierdzenie SaMD w UE może się znacznie różnić w zależności od kilku czynników. Kluczowe determinanty obejmują klasyfikację urządzenia, złożoność, ścieżkę oceny zgodności, zaangażowanie NB oraz skuteczność procesu składania wniosków regulacyjnych.
SaMD wyroby medyczne w innych rynkach (UE/Australia/Korea)
- Kompleksowa strategia regulacyjna EU MDR w zakresie EU MDR dla SaMD.
- Wsparcie w zakresie informacji regulacyjnych i rynkowych.
- Usługi klasyfikacji i rejestracji produktów dla SaMD.
- Wsparcie regulacyjne dla dokumentów rozwojowych produktów SaMD .
- Usługi konsultacyjne w zakresie badań oceny klinicznej SaMD .
- Zarządzanie zmianami po zatwierdzeniu.
- Usługi EAR/UKRP/CH-Rep.

- Udane zgłoszenia dla różnych klas SaMD.
- Dedykowany i doświadczony personel zapewniający wsparcie regulacyjne.
- Terminowe dostarczanie rezultatów.
- Dostęp do lokalnych oddziałów w celu sprostania wyzwaniom stawianym Health Authority (HA) służby Health Authority (HA) i wymaganiom językowym.
- Wsparcie w kraju lub wsparcie przedstawiciela prawnego (LR) w opłacalnym modelu.
- Usługi zarządzania zasobami regulacyjnymi/zwiększania personelu.





