
Czy wiesz, że? Można zaoszczędzić nawet milion złotych w ciągu najbliższych trzech (03) lat, wprowadzając Computer Software Assurance (CSA) w miejsce istniejącego modelu walidacji systemu komputerowego (CSV)!
Z biegiem lat organizacje farmaceutyczne wdrożyły CSV, podejście walidacyjne oparte na ryzyku, aby zapewnić zgodność komputerowych systemów operacyjnych z wymogami regulacyjnymi.
Ponieważ branża przygotowuje się obecnie do kolejnej transformacji (obok podejścia opartego na ryzyku), czyli CSA, USFDA opublikować w 2022 r. nowe wytyczne dotyczące CSA, aby pomóc organizacjom zrozumieć jakość produktów i zgodność z przepisami. Wytyczne mają zapewnić jasne zrozumienie, w jaki sposób, gdzie i jakie działania należy podjąć, aby przeprowadzić skuteczną ocenę ryzyka oprogramowania.
Omówmy teraz szeroko porównanie CSV i CSA z perspektywy procesów, ludzi i technologii; oraz w jaki sposób udane wdrożenie CSA może zapewnić wymierne korzyści dla organizacji.
Proces
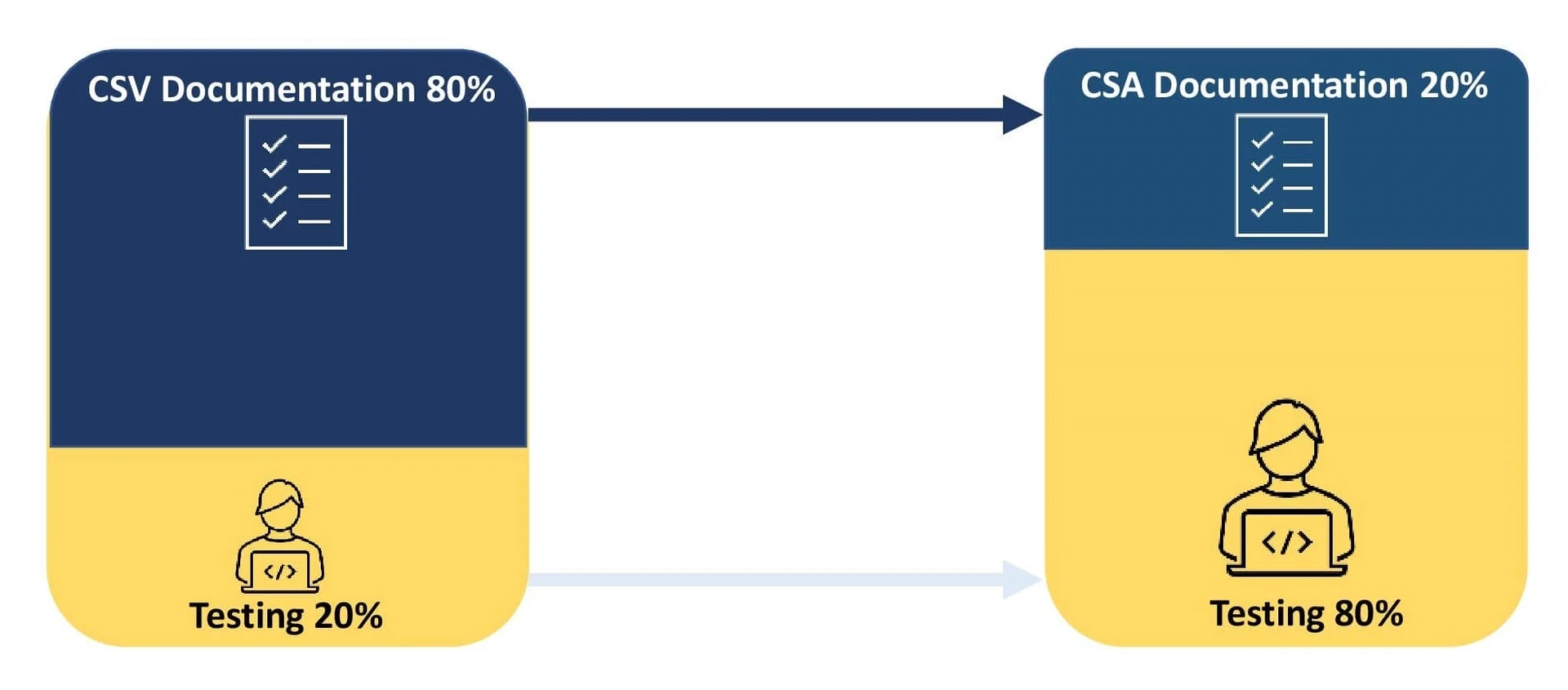
Walidacja systemu komputerowego (CSV) to udokumentowane podejście skoncentrowane na zgodności, które działa jako dowód zapewniający, że system jest odpowiedni do zamierzonego celu.
Organizacja inwestuje 80% swoich wysiłków w dokumentację procesu walidacji i 20% w testowanie. Wszelkie rozbieżności w testach CSV w powiązaniu z oczekiwanymi wynikami wymagają dokumentacji i wdrożenia planu działań naprawczych.
Computer Software Assurance (CSA) to podejście zorientowane na jakość, które kładzie nacisk na wpływ systemu oprogramowania na bezpieczeństwo pacjentów, jakość produktu i integralność danych.
Głównym celem jest skupienie się na walidacji i dokumentowaniu działań związanych z ryzykiem bezpieczeństwa w oparciu o złożoność oprogramowania. Takie podejście zachęca do korzystania z cyfryzacji i automatyzacji, poprawiając tym samym jakość produktu. Skrócenie procesu dokumentowania pomaga organizacjom reagować na krytyczne kwestie związane z oprogramowaniem i zachować zgodność z wytycznymi organów ochrony zdrowia. CSA wykorzystuje systemy jakości dostawców do nieskryptowanego testowania w celu walidacji systemów niskiego ryzyka, umożliwiając organizacjom inwestowanie 80% wysiłków w testowanie i 20% wysiłków w dokumentację.
W związku z tym procesy powinny zostać dostosowane (zmienione) tak, aby odzwierciedlały podejście CSA na różnych etapach cyklu SDLC, co można osiągnąć poprzez:
- Jakość poprzez projektowanie (QbD) – Priorytetowe traktowanie bezpieczeństwa pacjentów i jakości produktów gwarantuje, że głównym celem zainstalowanego oprogramowania jest spełnienie wymagań użytkowników w zakresie optymalizacji jakości produktów.
- Strategia walidacji oparta na ryzyku wymaga czujnego testowania i dokumentowania systemów podatnych na awarie/wady w przypadkach bezpośredniego ryzyka i mniej w przypadkach pośredniego lub braku ryzyka.
- Ponowne przemyślenie stosunku dokumentacji do testowania umożliwia sponsorom przedefiniowanie procesu walidacji poprzez poproszenie ich o poświęcenie 80% wysiłku na testowanie i 20% wysiłku na dokumentację.
- Zapewnienie wymiernych korzyści poprzez złagodzenie presji związanej z dokumentacją.
Ludzie
Czynnikiem różnicującym CSV i CSA jest hierarchia strategii. CSV obserwuje dokumentację, po której następuje testowanie i krytyczne myślenie, podczas gdy CSA obserwuje krytyczne myślenie jako pierwszy krok, po którym następuje testowanie i dokumentacja. CSV wykazuje udokumentowane dowody zapewniające wydajność i skuteczność, że skomputeryzowany system prowadzi działania zgodnie z wcześniej uzgodnionymi specyfikacjami i atrybutami jakości. Z drugiej strony, CSA zaleca sponsorowi ulepszenia procesu śledzenia w celu ograniczenia ryzyka i możliwych błędów.
Na poziomie przywództwa należy poszerzyć zakres krytycznego myślenia poprzez posiadanie wielu sposobów radzenia sobie z niepewnymi sytuacjami, ponieważ nie ma "jednego" właściwego sposobu na osiągnięcie czegokolwiek. Krytyczne myślenie otworzy drzwi dla innowacji w celu opracowania niezawodnych produktów.
Na poziomie praktyki i zastosowań należy szkolić ludzi i przygotowywać ich do transformacji i adaptacji do CSA poprzez efektywną współpracę i skuteczne programy szkoleniowe.
Perspektywa technologiczna
Kompleksowe wytyczne dotyczące CSV zostały już wprowadzone przez organy regulacyjne, takie jak USFDA, EMA, MHRA i wiele innych. Czy zatem potrzebujemy CSA? Odpowiedź brzmi: tak. CSA pozwoli spojrzeć na cel walidacji z odpowiedniej perspektywy i wyeliminuje rozbieżności między sponsorami a organami ds. zdrowia. Istnieją odpowiednie regulacje i wytyczne branżowe, które organizacje farmaceutyczne muszą zrozumieć, aby uzyskać korzyści biznesowe poprzez uproszczenie podejścia do procesu walidacji. Przejście z tradycyjnego CSV do CSA powoduje przesunięcie priorytetów organizacji z zapewnienia zgodności z przepisami na jakość i bezpieczeństwo produktów. Taka zmiana maksymalizuje efekt procesu walidacji poprzez zmniejszenie obciążenia związanego z rozbudowaną dokumentacją, harmonogramem projektu i kosztami ponoszonymi przez firmy z branży nauk przyrodniczych.
Zarówno na poziomie strategicznym, jak i operacyjnym, można to osiągnąć poprzez zachęcanie do cyfryzacji i automatyzacji, ograniczając wszelkie możliwe zagrożenia i błędy ludzkie.
Wnioski
Ponieważ wytyczne US FDAdotyczące CSA nie zostały jeszcze opublikowane, organizacje farmaceutyczne powinny aktywnie rozpocząć prace nad opracowaniem protokołów przejścia z CSV na CSA. Organizacje muszą:
- Ponowna ocena i identyfikacja systemów mających bezpośredni i pośredni wpływ na bezpieczeństwo pacjentów, jakość produktów i integralność danych.
- Przydzielenie zasobów zdolnych do zapewnienia płynnej zmiany w procesie walidacji.
- Przeprowadzenie analizy luk w stosunku do istniejącego systemu w celu zidentyfikowania wszelkich rozbieżności.
Ocena podejścia do walidacji mówi, co organizacja może zrobić, aby wprowadzić zmiany, gdy napotkają jakikolwiek problem z systemem. Prawidłowe wykonanie procesu CSV wymaga dogłębnego zrozumienia systemu i wglądu w sposoby jego wykorzystania.
Obecnie organizacje potrzebują współpracy z ekspertami CSV, którzy będą moderować proste i złożone projekty oraz pomogą w płynnym przejściu z CSV do CSA. Ramy kontroli jakości minimalizują konieczność ponownej pracy w procesie walidacji produktu i dostawcy, aby zapewnić całkowitą zgodność i walidację na każdym etapie wdrażania, konserwacji i wycofania z eksploatacji po niezwykle konkurencyjnej cenie. Reach z Freyr zgodności.









