Podczas gdy innowatorzy lub markowe produkty lecznicze ponoszą dodatkowe koszty związane z badaniami i rozwojem produktu od etapu identyfikacji cząsteczki do dopuszczenia do obrotu po wprowadzeniu na rynek, leki generyczne są stosunkowo opłacalne. Terapie te nie tylko zmniejszają całkowity koszt leczenia, ale także znacznie poprawiają dostęp pacjentów do leków ratujących życie. Ponieważ zależność od importu generycznych antybiotyków i terapii lekowej rzadkich chorób wpłynęła na dostępność tych produktów leczniczych na całym świecie w czasie pandemii, agencje zdrowia wprowadzają nowe wytyczne wspierające lokalnych producentów leków.
Od 1993 r. organizacja handlowa Medicines for Europe, wcześniej znana jako Europejskie Stowarzyszenie Leków Generycznych (EGA), konsekwentnie realizuje swój cel, jakim jest zapoznanie europejskiej populacji pacjentów z opłacalną terapią. W ciągu ostatniej dekady z powodzeniem dostarczyła 67% wszystkich leków do Europy, zwiększając dostęp pacjentów do 100% w siedmiu (07) kluczowych obszarach terapeutycznych. W ramach kompetencji europejskich organów ds. zdrowia, "strategiczna autonomia" po Brexicie uruchomiła natychmiastowy wymóg skutecznego zaradzenia niekorzystnej sytuacji konkurencyjnej, z jaką borykają się europejscy producenci leków generycznych i biopodobnych. Wraz z nadejściem pandemii COVID-19 możliwości globalnego łańcucha dostaw ugięły się pod presją zapotrzebowania na leki. Leki ratujące życie, które przynosiły ulgę w przewlekłych chorobach, zniknęły z półek lokalnych aptek. Aby pokonać przeszkody związane z chronionymi patentami produktami leczniczymi i zbudować lokalne możliwości produkcji leków w celu poprawy dostępu pacjentów, Rada UE przyjęła rozporządzenie, które stanowi wyjątek od oryginalnej cząsteczki, zapewniając dodatkowe świadectwo ochronne (SPC). Przepis ten ułatwia wytwarzanie leków generycznych i biopodobnych przed wygaśnięciem patentu w celu gromadzenia zapasów lub eksportu. Wyjątek będzie miał jednak zastosowanie tylko w następujących okolicznościach.
- Produkowane leki generyczne lub biopodobne są przeznaczone wyłącznie na eksport do innego kraju, w którym patent na cząsteczkę leku nie istnieje lub wygasł, lub do celów magazynowych w okresie obowiązywania patentu wynoszącym sześć (06) miesięcy.
- Zgodnie z wymogami, producent przekazał informacje lokalnemu organowi ds. zdrowia i posiadaczowi SPC przed upływem trzech (03) miesięcy.
- Producent poinformował wszystkie zainteresowane strony o komercjalizacji produktu.
- Producent zapewnił, że wymogi dotyczące etykietowania wskazują, że produkt leczniczy jest przeznaczony wyłącznie do celów eksportowych.
W rzeczywistości
Od momentu wydania warunkowego Pozwolenie na dopuszczenie do obrotu produktu leczniczego szczepionek przeciwko COVID-19 w UE, Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) Europejskiej Agencji Leków zatwierdził cztery (04) zakłady produkcji szczepionek w ciągu roku; dwa (02) w Szwajcarii i dwa (02) w USA. Takie decyzje dotyczące rozszerzenia zakładów produkcyjnych zwiększą możliwości wytwarzania szczepionek, jednocześnie zapewniając europejskiej ludności lepszy dostęp do nich.
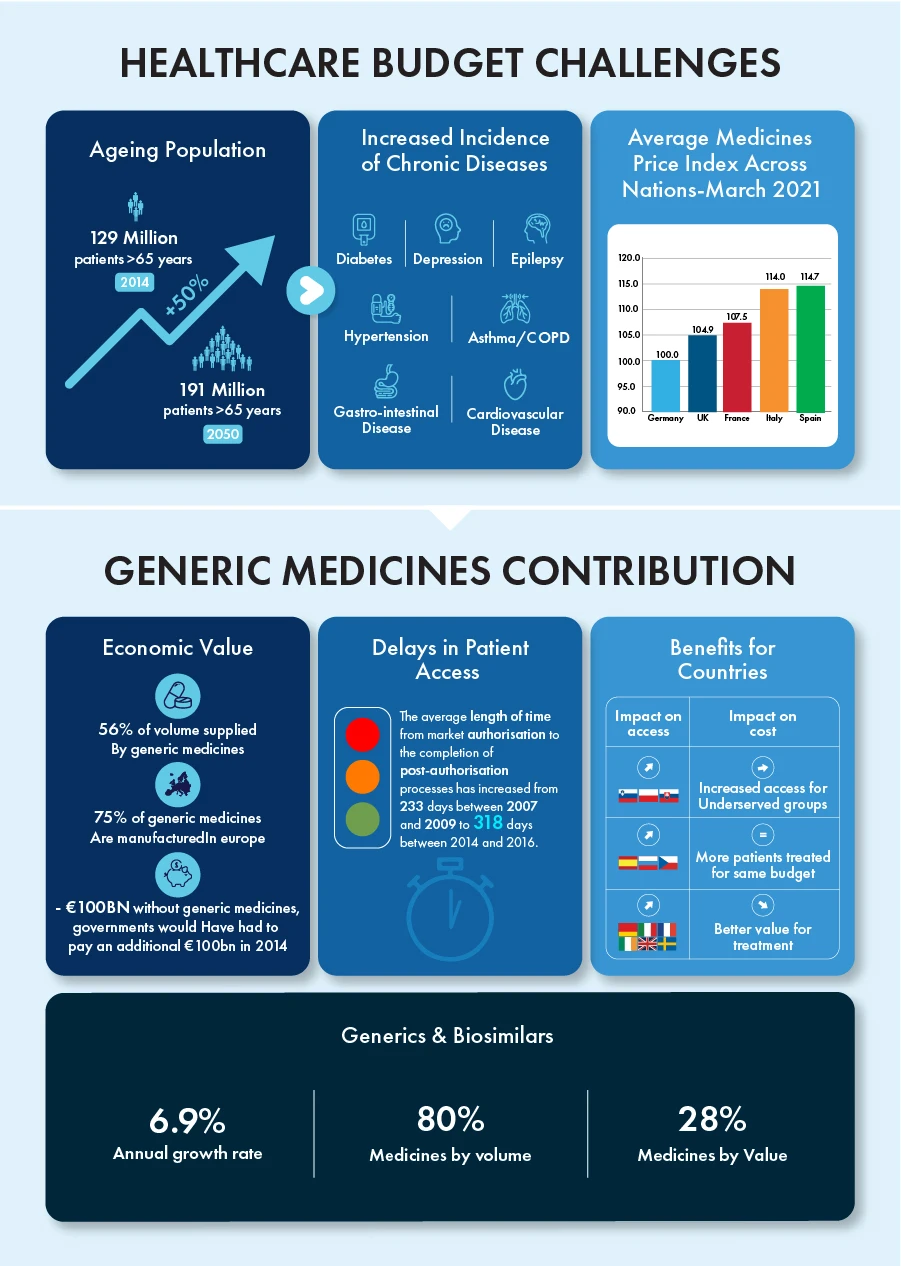
Leki generyczne i biopodobne w pojedynkę przyczyniły się do rocznej stopy wzrostu na poziomie 6,9%, stanowiąc 80% wszystkich leków pod względem ilości i 28% pod względem wartości w ciągu ostatniej dekady. Okres obowiązywania patentów na niektóre leki biologiczne o wartości około 90 miliardów euro zakończy się do 2023 roku, tworząc konkurencyjne środowisko dla tych produktów o ogromnym potencjale wzrostu.
Wdrożenie zwolnienia z SPC przyniosłoby korzyści Unii Europejskiej poprzez:
- Daje to dodatkowe około 90,5 mld euro rocznie.
- Stworzenie dwudziestu pięciu tysięcy (25 000) nowych miejsc pracy, w tym dwóch tysięcy (2000) bezpośrednich miejsc pracy dla branży API w UE. Inicjatywa ta pomoże member states UE member states 3,1 mld euro na wydatkach związanych z opieką zdrowotną.
- gromadzenie zapasów tańszych odpowiedników opatentowanych leków innowacyjnych w celu umożliwienia im wejścia na rynek natychmiast po wygaśnięciu praw własności intelektualnej, co poprawi dostęp pacjentów.
Dla producenta leków z siedzibą poza Unią Europejską wdrożenie zwolnienia z wymogu posiadania SPC jest jedną z najbardziej opłacalnych inicjatyw sprzyjających lekom generycznym. Ponieważ organ ds. zdrowia UE reguluje leki stosowane u ludzi i zwierząt w ramach scentralizowanej lub zdecentralizowanej procedury, poruszanie się po konkretnych lokalnych wymaganiach może być przytłaczające. Ekspert znający lokalne wymagania dotyczące różnych wniosków i dokumentów licencyjnych może pomóc Ci skoncentrować się na niezbędnych protokołach produkcyjnych, zamiast skupiać się na skomplikowanych przeszkodach regulacyjnych. Odkryj na nowo potencjał swojej firmy, doświadczając zgodności z przepisami i wysokiej jakości. Skontaktuj się Freyr.









