Przegląd rejestracji urządzeń medycznych w Kolumbii
Kolumbia oferuje ogromne możliwości dla firm produkujących wyroby medyczne, a jej system opieki zdrowotnej słynie z dbałości o bezpieczeństwo pacjentów i jakość usług medycznych. wyroby medyczne podlegają wyroby medyczne INVIMA (Krajowego Instytutu Nadzoru Żywności i Leków). INVIMA jest organem odpowiedzialnym za rejestrację wyrobów medycznych w Kolumbii.

Organ regulacyjny: INVIMA (Krajowy Instytut ds. Nadzoru nad Żywnością i Lekami)
Rozporządzenie: Dekret 4725/2005
Ścieżka regulacyjna: Rejestracja urządzenia
Upoważniony przedstawiciel: Przedstawiciel prawny Kolumbii
Wymóg SZJ: ISO 13485:2016 / MDSAP
Ocena danych technicznych: INVIMA
Wymagania dotyczące etykietowania: Dokumenty etykietujące muszą być w języku hiszpańskim
Ważność licencji: 10 lat
Format zgłoszenia: Elektroniczny
Klasyfikacja urządzeń medycznych w Kolumbii
| Klasyfikacja urządzeń medycznych | |
|---|---|
| Klasa I (najniższe ryzyko) | |
| Klasa IIa | |
| Klasa IIb | |
| Klasa III (najwyższe ryzyko) | |
Przedstawiciel prawny Kolumbii
Aby zostać przedstawicielem prawnym w Kolumbii, należy posiadać obywatelstwo kolumbijskie lub niezbędne zezwolenie prawne na pobyt i pracę w tym kraju jako obcokrajowiec. Przedstawiciel prawny może pomagać i zarządzać wszystkimi procedurami rejestracyjnymi w Kolumbii, działając jako łącznik między spółką a INVIMA, lokalnym organem regulacyjnym.
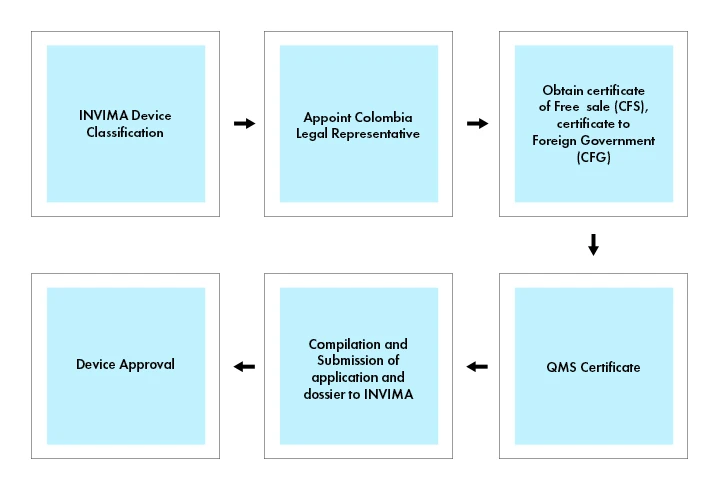
Rejestracja urządzeń medycznych w Kolumbii
wyroby medyczne wyroby do diagnostyki in vitro podlegają procedurze rejestracji, więc wyroby medyczne muszą być zarejestrowane w INVIMA, aby mogły być wprowadzane do obrotu w Kolumbii.
Aby wprowadzić wyrób medyczny do obrotu w Kolumbii, wymagane jest uzyskanie Certyfikatu Wolnej Sprzedaży (CFS) lub Certyfikatu dla Obcego Rządu (CFG) wydanego przez odpowiednią agencję regulacyjną w kraju pochodzenia lub uznanym kraju referencyjnym (np. w Kanadzie, Japonii, Australii, Unii Europejskiej i Stanach Zjednoczonych). Świadectwo wolnej sprzedaży lub świadectwo dla obcego rządu służy jako dowód, że wyrób medyczny spełnia niezbędne normy bezpieczeństwa i jakości do sprzedaży w Kolumbii.
Przepływ procesu
Zarządzanie cyklem życia urządzenia po zatwierdzeniu
Freyr wspiera zagranicznych producentów w end-to-end zarządzaniu cyklem życia urządzeń end-to-end , w tym w działaniach po uzyskaniu zatwierdzenia, takich jak:
- Zarządzanie zmianami po zatwierdzeniu - modyfikacje istniejących zatwierdzeń urządzeń medycznych, takie jak dodanie nowych wariantów, akcesoriów; dodanie nowych wskazań do stosowania, między innymi
- Utrzymanie zatwierdzeń i rejestracji poprzez terminowe uiszczanie opłat administracyjnych i rejestracyjnych.
- Odnowienie licencji
- Współpraca między INVIMA a producentem
Podsumowanie
| Klasyfikacja urządzeń medycznych | Nowe licencje i odnowienia | ||
|---|---|---|---|
| Nowa rejestracja | Poprawka | Odnowienie | |
| Klasa I | 4-6 miesięcy | 2-3 miesiące | 4-6 miesięcy |
| Klasa IIa | 4-6 miesięcy | 2-3 miesiące | 4-6 miesięcy |
| Klasa IIb | 4-6 miesięcy | 2-3 miesiące | 4-6 miesięcy |
| Klasa III | 4-6 miesięcy | 2-3 miesiące | 4-6 miesięcy |
| Opłaty rejestracyjne | |||||
|---|---|---|---|---|---|
| Nowe licencje i odnowienia | Modyfikacje techniczne | Modyfikacje administracyjne | |||
| Klasa I i klasa IIa | Klasa IIb i klasa III | Klasa I i klasa IIa | Klasa IIb i klasa III | Klasa I i klasa IIa | Klasa IIb i klasa III |
| $ 690,00 | $ 776,00 | $ 196,00 | $ 196,00 | $ 153,00 | $ 153,01 |
Ekspertyza Freyr
- Należyta staranność regulacyjna
- Oficjalna klasyfikacja
- Rejestracja urządzenia
- Posiadacz rejestracji w Kolumbii
- Obsługa etykietowania
- Wsparcie w zakresie tłumaczeń
- Identyfikacja i kwalifikacja dystrybutorów
- Nadzór po wprowadzeniu na rynek
- Zarządzanie zmianami po zatwierdzeniu
- Odnowienie i przeniesienie licencji
- Składanie wniosków i współpraca z INVIMA