Przegląd usług zgodności z rozporządzeniem UE IVDR
Europejskie rozporządzenie w sprawie wyrobów medycznych do diagnostyki in vitro (EU IVDR) stanowi nową podstawę prawną wprowadzania wyrobów medycznych do diagnostyki in vitro na rynek europejski. Rozporządzenie EU IVDR ma zastąpić obecną dyrektywę UE w sprawie wyroby medyczne do diagnostyki in vitro wyroby medyczne UE 98/79/WE). Jako rozporządzenie europejskie będzie ono obowiązywać we wszystkich Member States UE Member States w państwach Europejskiego Stowarzyszenia Wolnego Handlu (EFTA) bez konieczności transpozycji do prawa poszczególnych państw. Jako sprawdzony partner regulacyjny, Freyr usługi w zakresie zgodności z EU IVDR oraz usługi doradcze dla producentów w zakresie zgodności z przepisami dotyczącymi wyrobów medycznych do diagnostyki in vitro oraz oznakowania CE.
Rozporządzenie IVDR - harmonogram przejścia
Nowy unijny IVDR, który ma obowiązywać od 26 maja 2022 r., jest uważany za znaczącą zmianę w nadzorze regulacyjnym nad IVD. Poniżej znajduje się przegląd przejścia na IVDR.
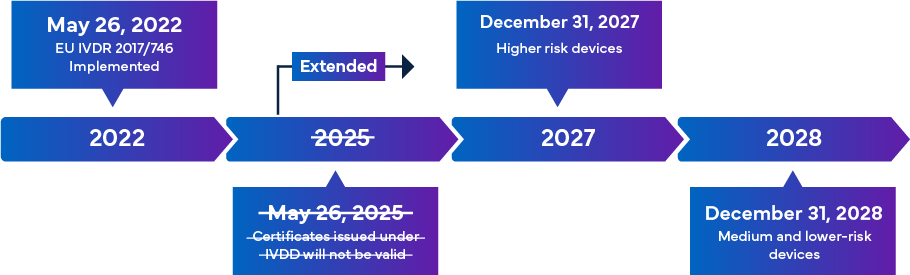
Po pełnym wdrożeniu, zasady zgodności z IVDR zapewniają, że prawie wszystkie produkty IVD wprowadzane na rynek europejski podlegają przeglądowi jednostki notyfikowanej IVDR (NB) i certyfikacji oznakowania CE w ramach procesu zatwierdzania IVD. W tym scenariuszu, oprócz dostosowania się do zaktualizowanej klasyfikacji IVDR, istnieje natychmiastowy wymóg, aby producenci dokonali skutecznego przeglądu kluczowej dokumentacji technicznej w celu pomyślnej rejestracji IVD i oznakowania CE. Wymagania IVDR różnią się w zależności od klasy ryzyka IVD. Ogólnie rzecz biorąc, w przypadku certyfikacji IVD producenci muszą wykonać:
- Przeglądy dokumentacji technicznej zgodnie z rozporządzeniem IVDR (rozporządzenie UE 2017/746)
- Przygotowanie raportu oceny wydajności (PER) dla wszystkich urządzeń IVD
- Działania następcze po wprowadzeniu do obrotu (PMPF) zgodnie z załącznikiem XIII część B do IVDR
- Zgłaszanie czujności zgodnie z art. 82 IVDR
Freyr wspiera klientów w przeprowadzaniu systematycznego przeglądu literatury naukowej oraz pomaga w planowaniu i przygotowywaniu PER w celu zapewnienia zgodności z przepisami dotyczącymi wyrobów medycznych do diagnostyki in vitro. Freyr dysponuje wyspecjalizowanymi ekspertami, którzy świadczą usługi doradcze w zakresie IVDR oraz Post-market Surveillance (PMS) , który wraz z monitorowaniem działania po wprowadzeniu do obrotu (PMPF) stanowi integralną część systemu zarządzania jakością producenta.
Uzyskaj porady ekspertów w zakresie zgodności z unijnym rozporządzeniem IVDR
Wiedza specjalistyczna i zalety usług w zakresie zgodności z rozporządzeniem UE IVDR
- Plan przejścia na zgodność z IVDR
- Przegląd techniczny i analiza luk w wymaganiach IVDR dla GSPR (ogólne wymagania dotyczące bezpieczeństwa i wydajności)
- Wspieranie kompilacji dokumentacji technicznej zgodnie z wymogami IVDR
- Raporty dotyczące ważności naukowej oparte na literaturze i/lub danych wewnętrznych
- Raporty wydajności klinicznej oparte na literaturze i/lub danych wewnętrznych
- Dowody kliniczne lub raporty z oceny wyników
- Protokoły i raporty z działań następczych po wprowadzeniu do obrotu (PMPF)
- Post-market Surveillance (PMS) i raporty dotyczące Post-market Surveillance (PMS)
- Pisanie/poprawianie innych dokumentów, takich jak ulotka dołączona do opakowania/IFU (instrukcja obsługi), skrócona instrukcja obsługi (QRI), instrukcja obsługi/użytkownika itp.

- Zapewniona zgodność z IVDR, rejestracja IVD i oznakowanie CE
- Dogłębne zrozumienie przepisów i wiedza specjalistyczna w kluczowych obszarach wpływu EU IVDR
- Silny model realizacji oparty na zarządzaniu projektami w celu zapewnienia zgodności z harmonogramem
- Wewnętrzni eksperci NB (przegląd raportu przez interaktywnych recenzentów NB)
- Skoncentrowane zespoły z wiedzą specjalistyczną na temat określonych obszarów wpływu i kategorii urządzeń.
- Wielofunkcyjny wkład ekspertów w dziedzinie urządzeń medycznych w celu spełnienia wymagań
- Pełny zakres usług obejmujący zgodność, przegląd i planowanie
- Duże doświadczenie w utrzymywaniu spójności rezultatów (czas i jakość)