Przegląd usług w zakresie zgodności z EU MDR
Rozporządzenie UE w sprawie wyrobów medycznych (MDR) weszło w życie 26 maja 2021 r., po 3-letnim okresie przejściowym i dodatkowym rocznym przedłużeniu z powodu pandemii COVID-19. Urządzenia, które są obecnie wprowadzane na rynek UE, muszą być zgodne z tymi przepisami i muszą posiadać certyfikat CE zgodnie z EU MDR wydany przez jednostki notyfikowane akredytowane na mocy tych przepisów. Urządzenia, które uzyskały już certyfikat CE zgodnie z EU MDD, mają jednak okresy karencji, zanim będą musiały w pełni spełnić wymagania EU MDR . Podczas tego okresu karencji urządzenia certyfikowane zarówno zgodnie z EU MDD, jak i EU MDR MDR będą co na rynku z równym statusem i bez dyskryminacji. Freyr oferuje niezrównane usługi w zakresie zgodności z EU MDR EU MDR , aby pomóc firmom produkującym urządzenia medyczne spełnić wymogi EU MDR MDR w odpowiednim czasie.
Harmonogram przejścia i nowe klasyfikacje urządzeń
European Medical Device Regulation (MDR) będzie w pełni obowiązywać we wszystkich member states UE i państwach Europejskiego Stowarzyszenia Wolnego Handlu (EFTA) od maja 2021 r. i zapewnia producentom 4-letni okres przejściowy na pełną certyfikację MDR UE.
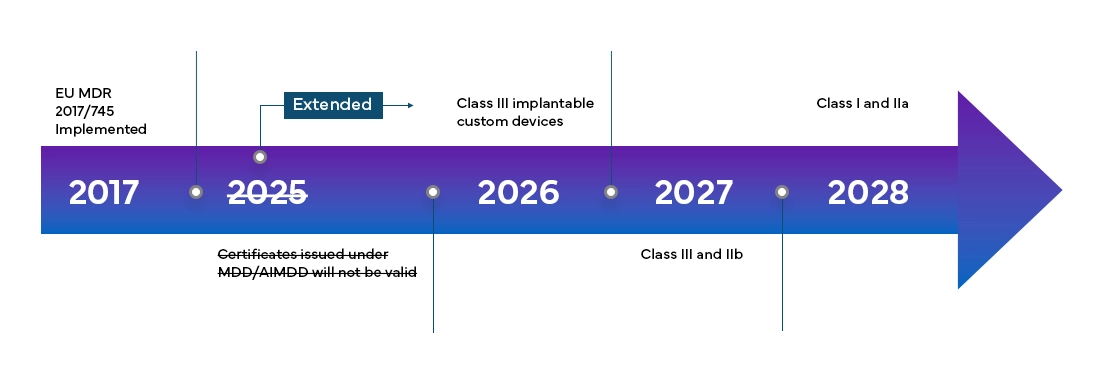
Nowe European Medical Device Regulation (MDR), jak zaobserwowano, wprowadziło również zmiany w istniejącym systemie klasyfikacji urządzeń, takie jak:
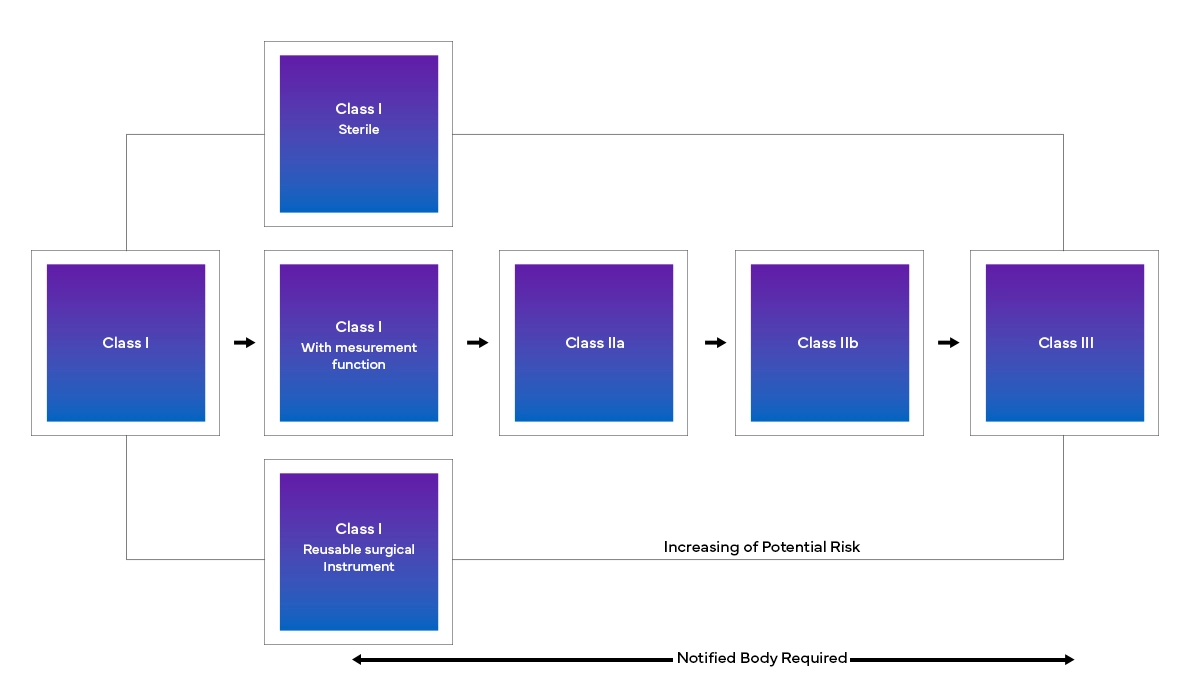
Począwszy od określenia dokładnych zmian, które należy wprowadzić, aż po ich wdrożenie w czasie rzeczywistym, producenci będą musieli zmierzyć się z szeregiem wyzwań, aby spełnić wymogi MDR UE. Począwszy od dekodowania nowej struktury, poprzez dokładną klasyfikację urządzenia, aż po zestawienie i przesłanie wszystkich danych, producenci będą musieli zastosować bardziej szczegółowe i wielofunkcyjne podejście regulacyjne, aby poradzić sobie z nowymi europejskimi przepisami dotyczącymi wyrobów medycznych. Dzięki rygorystycznej analizie luk Freyr pomaga klientom w utrzymaniu status quo i zapewnia niezbędne działania regulacyjne potrzebne do przejścia i zapewnienia zgodności z MDR UE.
Usługi w zakresie zgodności z EU MDR
- Opracowanie jasnej strategii wdrażania rozporządzenia w sprawie wyrobów medycznych (MDR)
- Zrozumienie nowych przepisów, przeprowadzenie analizy luk w obecnych systemach zarządzania jakością (QMS) i stosowanych procesach.
- Opracowanie szczegółowego planu z podejściem wielofunkcyjnym w celu określenia aspektów systemu jakości, które będą wymagały modyfikacji zgodnie z nowym rozporządzeniem UE w sprawie wyrobów medycznych.
- Tworzenie wielu zespołów do analizy zakresu produktu, klasyfikacji, obsługi QMS itp. w ramach organizacji, z jednym punktem kontaktowym w każdym zespole.
- Alokacja i planowanie zasobów
- Rozważenie interakcji systemu zarządzania jakością z innymi przepisami i wykorzystanie tej okazji do usprawnienia procesów, przy jednoczesnym zapewnieniu elastyczności w celu uwzględnienia przyszłych zmian.
- Analiza danych testowych i sprawdzenie wszelkich dodatkowych wymagań wprowadzonych przez MDR.
- Koordynowanie oczekiwań i planu przejścia z jednostkami notyfikowanymi UE
- Analiza luk dla istniejących wyroby medyczne dyrektywy MDD UE do EU MDR
- End-to-end w opracowaniu Clinical Evaluation Report (CER), w tym przegląd literatury zgodnie z wytycznymi European Medical Device Regulation EU MDR).
- End-to-end w zakresie raportów dotyczących nadzoru po wprowadzeniu do obrotu (PMSR), okresowych raportów dotyczących bezpieczeństwa (PSUR) oraz podsumowań dotyczących bezpieczeństwa i skuteczności klinicznej (SSCP)
- Wzmocnienie zasobów regulacyjnych z opcjami wdrażania zarówno na lądzie, jak i na morzu
- Usługi europejskiego autoryzowanego przedstawiciela (EAR)
- Zgodność z MDR i pomoc w składaniu wniosków do jednostek notyfikowanych
- Wywiad regulacyjny obejmujący proces importu z różnych rynków regulowanych
- Zgodność z QMS i próbne audyty
- System zarządzania dokumentami i narzędzie dla firm MDR
- Klasyfikacja i reklasyfikacja wyrobów według ryzyka
- Wdrożenie i doradztwo w zakresie UDI
- Usługi nadzoru po wprowadzeniu do obrotu zgodne z rozporządzeniem UE w sprawie wyrobów medycznych
- Doradztwo w zakresie zarządzania ryzykiem ISO 14971
- Szkolenia wewnętrzne i online
- Osoba odpowiedzialna za usługi i pomoc w zakresie zgodności z przepisami
- Identyfikacja jednostek notyfikowanych MDR

Aby uzyskać end-to-end wsparcie end-to-end w zakresie EU MDR, reach z Freyr.