Przegląd rejestracji urządzeń medycznych w Egipcie
Od września 2018 r. rejestracja wyrobów medycznych stała się obowiązkowa w Egipcie. Branża wyrobów medycznych w tym kraju odnotowuje stały wzrost, co sprawia, że jest to atrakcyjny rynek dla producentów i dystrybutorów. Przy wartości 4,0 mld USD w 2021 r. egipski wyroby medyczne ma osiągnąć średni roczny wzrost (CAGR) na poziomie ponad 3% w latach 2022–2027. Ze względu na stosunkowo niską produkcję lokalną popyt na wyroby medyczne Egipcie jest w dużej mierze zaspokajany przez import. Co ciekawe, egipski wyroby medyczne jest drugim co do wielkości rynkiem w regionie Bliskiego Wschodu i Afryki Północnej (MENA). Niniejszy przegląd omawia kluczowe aspekty egipskiego procesu rejestracji, przedstawiając ramy regulacyjne i wymagania dotyczące wprowadzania innowacyjnych wyroby medyczne rynek egipskiej opieki zdrowotnej.
Organ regulacyjny: Egipski Urząd ds. Leków (EDA)
Rozporządzenie: Egipska ustawa o urządzeniach medycznych nr 10 z 2003 r.
Ścieżka regulacyjna: Rejestracja produktu (normalna i przyspieszona) oraz urzędowa klasyfikacja
Egipt Lokalny upoważniony przedstawiciel: Egipski Posiadacz Rejestracji (ERH)
Wymagania dotyczące SZJ: ISO 13485
Ocena danych technicznych: Centrum Polityki Lekowej i Planowania (DPPC) oraz Centralna Administracja Spraw Farmaceutycznych (CAPA).
Ważność licencji: Dziesięć (10) lat
Format zgłoszenia: Papierowy i elektroniczny
Tłumaczenie: Przetłumaczone dokumenty w języku arabskim i angielskim
Klasyfikacja urządzeń
W Egipcie klasyfikacja wyrobów medycznych jest zgodna z europejskim systemem klasyfikacji, który dzieli wyroby medyczne ich przeznaczenia i potencjalnych zagrożeń związanych z ich stosowaniem. Producenci powinni określić prawidłową klasyfikację swoich wyrobów, aby zapewnić zgodność z wymogami regulacyjnymi i uzyskać niezbędne zezwolenia na wprowadzanie do obrotu i dystrybucję w Egipcie.
Klasy urządzeń medycznych
| Klasa | Ryzyko |
|---|---|
| Klasa I | Niski |
| Klasa II a | Niski-średni |
| Klasa II b | Średnio-wysoki |
| Klasa III | Wysoki |
Egipt Lokalny upoważniony przedstawiciel
Firmy produkujące wyroby medyczne z siedzibą poza Egiptem muszą wyznaczyć lokalnego przedstawiciela zwanego „egipskim posiadaczem rejestracji (ERH)”, który będzie zajmował się składaniem wniosków rejestracyjnych i dokumentacji do EDA w ich imieniu. ERH pełni funkcję łącznika między producentem a organem regulacyjnym, zapewniając dokładne przygotowanie i złożenie wszystkich wymaganych dokumentów oraz weryfikując, czy wyrób medyczny spełnia normy bezpieczeństwa, jakości i skuteczności EDA. Ponadto ERH jest odpowiedzialny za przechowywanie dokumentacji rejestracyjnej, zgłaszanie incydentów lub wycofywanie produktów oraz zapewnienie ciągłej zgodności ze wszystkimi obowiązującymi normami i przepisami przez cały cykl życia wyrobu. Egipski posiadacz rejestracji (ERH) ponosi całkowitą odpowiedzialność za zapewnienie rejestracji wyrobu medycznego w EDA, w szczególności w Centralnej Administracji wyroby medyczne. Rola ta obejmuje zapewnienie zgodności wyrobu z wymogami regulacyjnymi EDA dotyczącymi wprowadzania do obrotu i dystrybucji w Egipcie.
Rejestracja urządzeń medycznych
Uzyskanie Pozwolenie na dopuszczenie do obrotu produktu leczniczego wyrobu medycznego w Egipcie obejmuje kilka etapów, w tym przygotowanie wymaganej dokumentacji, złożenie wniosku do EDA, przestrzeganie wymagań dotyczących klasyfikacji i systemu jakości, wyznaczenie ERH w razie potrzeby oraz wypełnienie obowiązków po wprowadzeniu produktu do obrotu. Proces rejestracji ma kluczowe znaczenie dla zagwarantowania wyroby medyczne z określonymi normami bezpieczeństwa, jakości i skuteczności ustanowionymi przez egipski organ regulacyjny. Wymagana dokumentacja może się różnić w zależności od wybranej ścieżki rejestracji, ale zazwyczaj obejmuje następujące elementy:
- Certyfikat CE (jeśli dotyczy).
- Certyfikat wolnej sprzedaży (CFS).
- Certyfikat ISO 13485 .
- Deklaracja zgodności (DOC).
Przepływ procesu
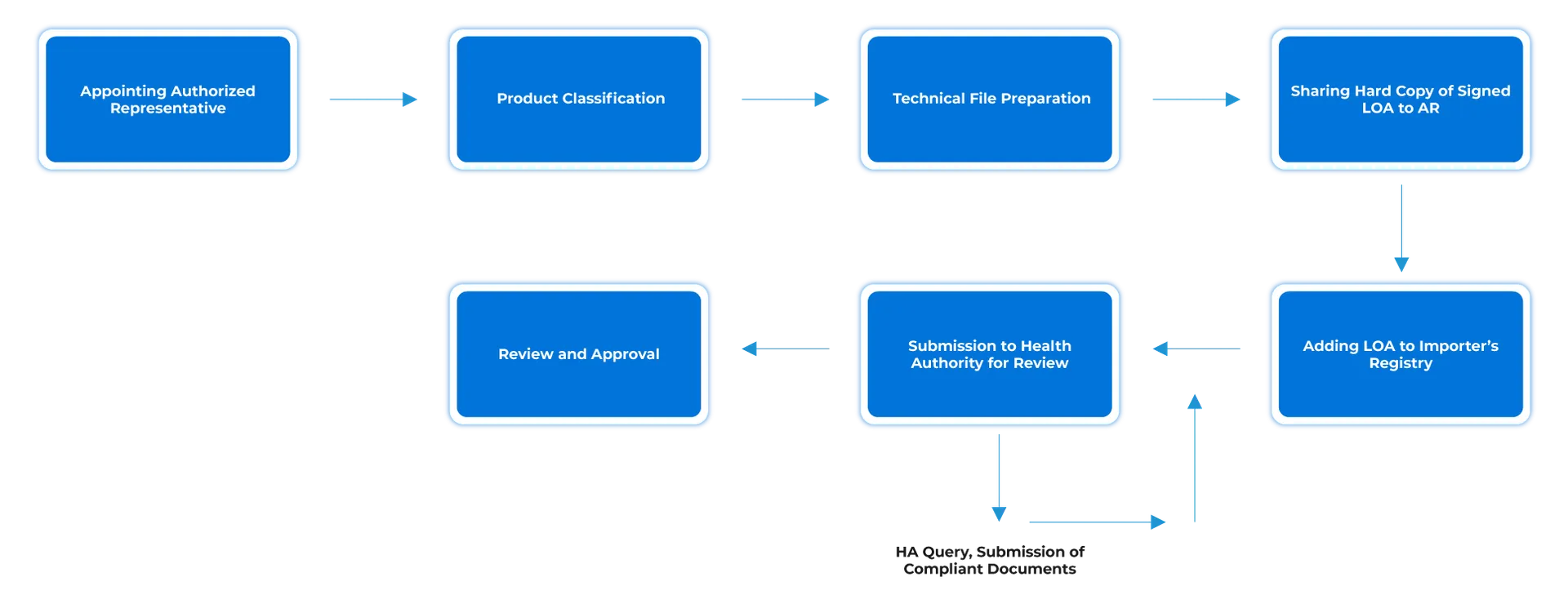
Zarządzanie cyklem życia urządzenia po jego zatwierdzeniu
Freyr zapewnia kompleksowe wsparcie zagranicznym producentom w zarządzaniu całym cyklem życia wyroby medyczne Egipcie, w tym działaniami po uzyskaniu zatwierdzenia:
- Zarządzanie zmianami po zatwierdzeniu, obejmujące modyfikacje istniejących zatwierdzeń urządzeń medycznych, takie jak dodanie nowych wariantów, akcesoriów i wskazań do stosowania.
- Utrzymanie zgodności z ISO 13485:2016.
- Certyfikat CE.
- Pełnienie roli pośrednika między jednostką notyfikowaną (NB) a producentem.
- System nadzoru służący monitorowaniu bezpieczeństwa wyrobu medycznego po uzyskaniu przez niego Pozwolenie na dopuszczenie do obrotu produktu leczniczego.
- Dostarczanie okresowych aktualizacji dotyczących bezpieczeństwa i skuteczności urządzenia medycznego, a także wszelkich zmian w statusie regulacyjnym w innych jurysdykcjach.
- Odnowienie Pozwolenie na dopuszczenie do obrotu produktu leczniczego, w zależności od rodzaju wyrobu i przepisów, po upływie określonego czasu.
Skuteczne zarządzanie Post-market Surveillance (PMS) Egipcie wymaga umiejętnego poruszania się po ramach regulacyjnych ustanowionych przez EDA. Podmioty wchodzące na rynek, które borykają się z tymi zawiłościami i nie mają ustalonego partnera regulacyjnego, mogą skorzystać z szerokiego zakresu usług regulacyjnych oferowanych przez Freyr. Usługi te przyczyniają się do płynnego procesu zatwierdzania wyroby medyczne Egipcie, gwarantując ciągłą zgodność z nieustannie zmieniającym się otoczeniem regulacyjnym i dynamiką rynku.
Rejestracja urządzeń medycznych w Egipcie
- Wywiad regulacyjny.
- Należyta staranność regulacyjna.
- Klasyfikacja urządzeń medycznych.
- Rejestracja urządzenia.
- Egipski właściciel rejestracji.
- Obsługa tłumaczeń.
- Pisanie tekstów medycznych.
- Obsługa etykietowania.
- Identyfikacja i kwalifikacja dystrybutorów.
- Zarządzanie zmianami po zatwierdzeniu.
- Odnowienie i przeniesienie licencji.
- Odprawa celna.
