
Rejestracja urządzeń medycznych w Indonezji - przegląd
W 2014 roku Indonezja wprowadziła powszechny system opieki zdrowotnej dla swoich obywateli. Miało to duży wpływ na rozwój wyroby medyczne i spowodowało wzrost wyroby medyczne . Urządzenia w Indonezji są regulowane przez Krajową Agencję Kontroli Leków i Żywności (NADFC) działającą pod nadzorem indonezyjskiego Ministerstwa Zdrowia (MoH). Najnowszym rozporządzeniem dotyczącym importu wyroby medyczne dekret nr 62 wprowadzony w 2017 roku. Zagraniczne firmy muszą wyznaczyć lokalnego przedstawiciela w Indonezji do procesu rejestracji wyrobów medycznych w tym kraju.
Organ regulacyjny: Krajowa Agencja Kontroli Leków i Żywności (NADFC)
Rozporządzenie: Nr 62 / 2017
Upoważniony przedstawiciel: Indonezja Lokalny autoryzowany przedstawiciel
Wymóg SZJ: ISO 13485:2016
Ocena danych technicznych: NADFC
Ważność licencji: 5 lat
Wymagania dotyczące etykietowania: Nr 62 / 2017
Format zgłoszenia: Online/Papier
Język: Angielski i indonezyjski
Klasyfikacja urządzeń medycznych w Indonezji
Obecne rozporządzenie klasyfikuje urządzenia jako A, B, C i D w oparciu o ryzyko.
| Kryteria ryzyka | Klasa urządzenia |
|---|---|
| Niskie ryzyko | A |
| Niskie Umiarkowane Ryzyko | B |
| Umiarkowane - Wysokie ryzyko | C |
| Wysokie ryzyko | D |
Indonezja Lokalny autoryzowany przedstawiciel
Indonezyjskie przepisy wymagają od producentów wyznaczenia lokalnego przedstawiciela z licencją dystrybutora. Dystrybutor może zostać wyznaczony do reprezentowania zagranicznego producenta w Indonezji. Jednak wyznaczenie niezależnej strony trzeciej zapewniłoby elastyczność w zakresie zmiany dystrybutorów lub wyznaczenia wielu dystrybutorów w celu lepszej penetracji rynku.
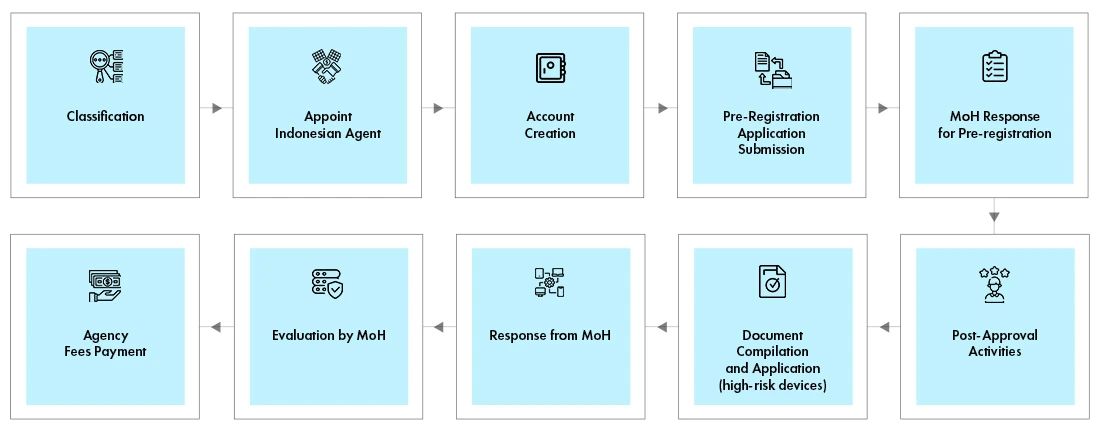
Rejestracja urządzeń medycznych w Indonezji
Lokalny przedstawiciel musi utworzyć konto w portalu internetowym. Proces rejestracji jest taki sam dla wszystkich klas urządzeń. Wymagana dokumentacja różni się jednak w zależności od klasy urządzenia. Rejestracja jest procesem dwuetapowym -
- Proces rejestracji wstępnej
- Proces oceny
MoH weryfikuje klasyfikację urządzenia i określa koszt oceny. Wynik rejestracji wstępnej wraz z fakturą jest przesyłany do wnioskodawcy pocztą elektroniczną. Lokalny przedstawiciel w imieniu producenta dokonuje płatności i przesyła dowód płatności. MoH dokona przeglądu dokumentów i udostępni wnioskodawcy wyniki za pośrednictwem poczty elektronicznej. Niektóre urządzenia wymagają przeprowadzenia testów w kraju w akredytowanym laboratorium.
Przegląd procesu zatwierdzania przez organy regulacyjne
Zespół ekspertów Freyrśledzi zmieniające się trendy i przepisy oraz pomaga interesariuszom w utrzymaniu zgodności z przepisami przez cały cykl życia produktu. Oferujemy rozwiązania regulacyjne w celu utrzymania innych aspektów zgodności z przepisami w ramach ograniczonych budżetów.
Klasa urządzenia | Klasa ryzyka | Harmonogramy MoH dla Pozwolenie na dopuszczenie do obrotu produktu leczniczego | Harmonogramy MoH dla Odnowienie/zmiana | ||
|---|---|---|---|---|---|
| Proces klasyfikacji (dni) | Proces oceny (dni) | Proces klasyfikacji (dni) | Proces oceny (dni) | ||
| Klasa A | Niskie ryzyko | 7 | 45 | 7 | 45 |
| Klasa B | Niskie Umiarkowane Ryzyko | 7 | 90 | 7 | 45 |
| Klasa C | Umiarkowane - Wysokie ryzyko | 7 | 100 | 7 | 45 |
| Klasa D | Wysokie ryzyko | 7 | 120 | 7 | 45 |
Ekspertyza Freyr
- Należyta staranność regulacyjna
- Rejestracja urządzenia
- Testy w kraju
- Licencjonowanie dystrybutorów
- Legalizacja i poświadczenie notarialne
- Przedstawiciel prawny
- Labelling
- Wsparcie w zakresie tłumaczeń
- Identyfikacja i kwalifikacja dystrybutorów
- Usługi nadzoru postmarketingowego
- Zarządzanie zmianami po zatwierdzeniu
- Usługi odnawiania i przenoszenia licencji
- Usługi składania wniosków i współpracy

