Przegląd rejestracji urządzeń medycznych w Izraelu
Branża urządzeń medycznych w Izraelu przeżywa okres trwałego wzrostu i innowacji, co czyni ją centrum najnowocześniejszych technologii medycznych. Rejestracja wyroby medyczne kluczowe wyroby medyczne dla firm wchodzących na ten dynamiczny rynek. Niniejszy przegląd omawia kluczowe aspekty procesu rejestracji w Izraelu, przedstawiając informacje na temat ram regulacyjnych i wymagań dotyczących wprowadzania innowacyjnych wyroby medyczne rynek izraelskiej opieki zdrowotnej.
Organ regulacyjny: Wydział Wyrobów Medycznych izraelskiego Ministerstwa Zdrowia (AMAR).
Rozporządzenie: Ustawa o wyrobach medycznych/sprzęcie medycznym z 2012 r.
Ścieżka regulacyjna: Rejestracja produktu
Lokalny autoryzowany przedstawiciel w Izraelu: Posiadacz rejestracji w Izraelu (IRH)
Wymagania dotyczące SZJ: ISO 13485
Ocena danych technicznych: wyroby medyczne Ministerstwa Zdrowia
Ważność licencji: Pięć (05) lat
Format zgłoszenia: Papierowy i elektroniczny
Tłumaczenie: Przetłumaczone dokumenty w języku hebrajskim
Klasyfikacja urządzeń
Izraelska ustawa o wyrobach medycznych i przepisy dotyczące rejestracji wyrobów medycznych nie określają systemu klasyfikacji ryzyka. Zamiast tego Izrael dostosowuje klasyfikację wyrobów medycznych do norm międzynarodowych, w szczególności tych określonych przez kraje należące do Globalnej Grupy Roboczej ds. Harmonizacji (GHTF). Alternatywnie, do rejestracji w Izraelu przyjmuje się klasyfikację ryzyka wyrobu obowiązującą w uznanym kraju. Proces klasyfikacji zazwyczaj uwzględnia przeznaczenie, poziom ryzyka i inne czynniki, które mogą mieć wpływ na bezpieczeństwo i skuteczność wyroby medyczne.
Klasy urządzeń medycznych
| Klasa | Ryzyko |
|---|---|
| Klasa I | Niski |
| Klasa II | Niski-średni |
| Klasa III | Wysoki |
Proponowane zmiany w ścieżkach rejestracji
Proponowane modyfikacje mają zastosowanie do urządzeń klasy I i II, natomiast system rejestracji urządzeń klasy III pozostaje bez zmian.
- Urządzenia klasy I mogą być natychmiast rejestrowane poprzez samodzielną deklarację.
- W przypadku urządzeń klasy II, mimo że wymagane są deklaracje i dokumentacja techniczna, AMAR może przyspieszyć proces do czternastu (14) dni dla urządzeń uznanych za niskiego lub średniego ryzyka. Ma to zastosowanie, jeśli producent posiada dwa (02) zezwolenia z uznanych krajów i dostarcza dane rynkowe z sześciu (06) miesięcy. Alternatywnie, w przypadku urządzeń klasy II posiadających jedynie zezwolenieFDA (k) oraz dane US z sześciu (06) miesięcy US , czas przetwarzania przez AMAR zostaje skrócony do sześćdziesięciu (60) dni.
Izrael Lokalny upoważniony przedstawiciel
Firmy produkujące urządzenia medyczne z siedzibą poza Izraelem muszą wyznaczyć izraelskiego posiadacza rejestracji (IRH), aby ułatwić rejestrację swoich produktów do sprzedaży w kraju. IRH działa jako lokalny przedstawiciel producenta i ma za zadanie współpracować z Ministerstwem Zdrowia w celu zapewnienia zgodności z lokalnymi przepisami. Ponadto IRH jest odpowiedzialny za ustanowienie i utrzymanie obecności biznesowej w Izraelu, a także uzyskanie i utrzymanie ważnej licencji biznesowej.
Rejestracja urządzeń medycznych
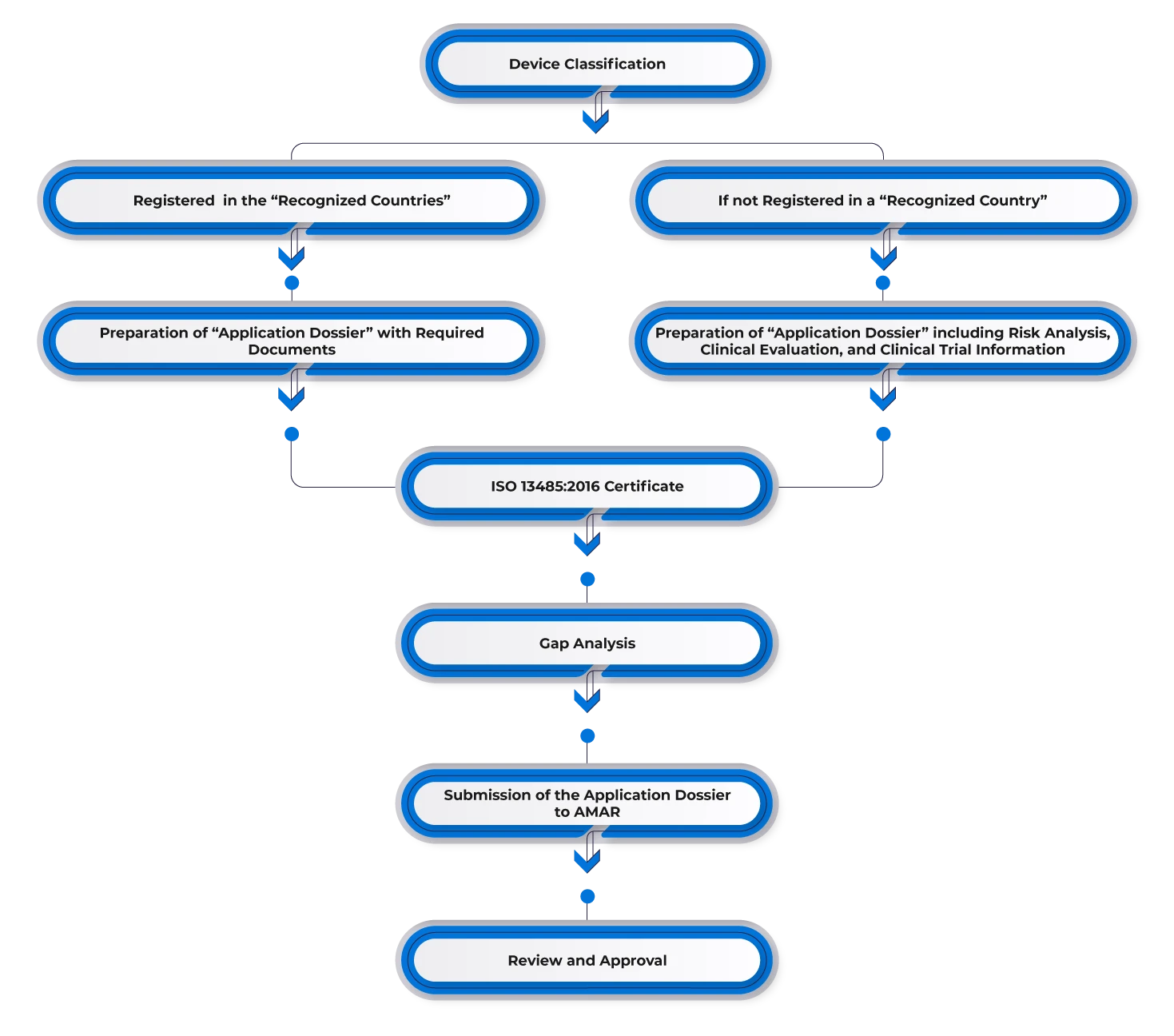
Aby zarejestrować urządzenie medyczne w Izraelu, producenci muszą uzyskać wcześniejsze zatwierdzenie na jednym z rynków referencyjnych, takich jak USA, Europa, Australia, Kanada lub inne główne rynki. Producenci posiadający istniejące zatwierdzenia w jednym z krajów referencyjnych mogą wykorzystać to zatwierdzenie na rynku izraelskim i wyznaczyć przedstawiciela krajowego. Następnie muszą przedłożyć wymaganą dokumentację, w tym:
- FDA (k)/List zatwierdzający przed wprowadzeniem do obrotu/CE.
- Certificate to Foreign Government (CFG)/Certificate of Free Sale (CFS).
- ISO 13485 inny uznany certyfikat dobrych praktyk produkcyjnych (GMP).
- Walidacja i certyfikacja Izraelskiego Instytutu Norm (w razie potrzeby).
Przepływ procesu
Zarządzanie cyklem życia urządzenia po jego zatwierdzeniu
Freyr zapewnia kompleksowe wsparcie zagranicznym producentom w zarządzaniu całym cyklem życia wyroby medyczne Izraelu, w tym działaniami po uzyskaniu zatwierdzenia:
- Zarządzanie zmianami po zatwierdzeniu, obejmujące modyfikacje istniejących zatwierdzeń urządzeń medycznych, takie jak dodanie nowych wariantów, akcesoriów i wskazań do stosowania.
- Utrzymanie certyfikatu ISO 13485:2016 i certyfikatu CE.
- Odnowienie licencji.
- Pełnienie roli pośrednika między jednostką notyfikowaną (NB) a producentem.
Poruszanie się po zawiłościach organów certyfikujących i przestrzeganie wielu zestawów przepisów dotyczących zatwierdzania urządzeń może stanowić wyzwanie. Uzyskanie zatwierdzeń od różnych krajów GHTF i przestrzeganie przepisów stanowych wymaga dogłębnej wiedzy regulacyjnej. Dla podmiotów wchodzących na rynek, które borykają się z tymi złożonymi kwestiami i nie mają ustalonego partnera regulacyjnego, Freyr oferuje end-to-end usługi end-to-end , usprawniające proces zatwierdzania wyroby medyczne Izraelu.
Rejestracja urządzeń medycznych w Egipcie
- Izraelska klasyfikacja urządzeń medycznych.
- Posiadacz rejestracji w Izraelu (IRH).
- Izrael Rejestracja urządzenia.
- ISO 14971:2019 Konsultacje w zakresie zarządzania ryzykiem.
- Zgodność z normą ISO 13485:2016.
- Przegląd, kompilacja i złożenie dokumentacji projektowej.
- Rejestracja wyroby medyczne internetowego systemu rejestracji.
- Raport dotyczący strategii regulacyjnej w zakresie wyrobów medycznych.
- Wsparcie testowe - biokompatybilność, bezpieczeństwo elektryczne, mechanika i wydajność.
- Wsparcie w zakresie zgodności etykietowania.
- Wsparcie GMP.
- Post-market Surveillance (PMS) .
