
Przegląd rejestracji urządzeń medycznych w Zjednoczonych Emiratach Arabskich
Zjednoczone Emiraty Arabskie (ZEA), ważny kraj członkowski GCC, posiada zaawansowany system opieki zdrowotnej. Jego potencjał rynkowy jest udowodniony i stale rośnie, zarządzany przez Departament Kontroli Leków Ministerstwa Zdrowia i Prewencji (MOHAP). Scentralizowane zarządzanie i bariery językowe są głównymi przeszkodami w rejestracji urządzeń medycznych w Zjednoczonych Emiratach Arabskich, wraz ze złożonością językową i brakiem skutecznych kanałów komunikacji z władzami zdrowotnymi.
Organ regulacyjny: Departament Kontroli Narkotyków Ministerstwa Zdrowia i Prewencji (MOHAP)
Rozporządzenie: Wytyczne wyroby medyczne w Zjednoczonych Emiratach Arabskich
Ścieżka regulacyjna: Rejestracja produktu
Upoważniony przedstawiciel: Wymagany jest lokalny autoryzowany przedstawiciel ZEA
Wymóg SZJ: ISO 13485:2016
Ocena danych technicznych: Komitet ds. rejestracji urządzeń medycznych
Ważność licencji: 5 lat
Wymagania dotyczące etykietowania: Załącznik 2 (2.5) do wytycznych wyroby medyczne w Zjednoczonych Emiratach Arabskich
Format zgłoszenia: Papier
Język: Angielski
Klasyfikacja urządzeń medycznych w Zjednoczonych Emiratach Arabskich
Zjednoczone Emiraty Arabskie mają odrębne zasady klasyfikacji wyroby medyczne wyrobów medycznych do diagnostyki in vitro. Zasady klasyfikacji wyrobów medycznych w Zjednoczonych Emiratach Arabskich są zgodne z zasadami klasyfikacji określonymi w dyrektywach UE dotyczących wyrobów medycznych. Klasy wyrobów zgodnie z zasadami klasyfikacji obowiązującymi w Zjednoczonych Emiratach Arabskich są następujące:
| Kryteria ryzyka | Klasa urządzenia medycznego |
|---|---|
| Niskie ryzyko | I |
| Niskie Umiarkowane Ryzyko | IIa |
| Umiarkowane - Wysokie ryzyko | IIb |
| Wysokie ryzyko | III |
| Kryteria ryzyka | Klasa IVD |
|---|---|
| Niskie ryzyko indywidualne i niskie ryzyko dla zdrowia publicznego | A |
Umiarkowane ryzyko indywidualne i/lub niskie ryzyko dla zdrowia publicznego | B |
Wysokie ryzyko indywidualne i/lub Umiarkowane zagrożenie dla zdrowia publicznego | C |
| Wysokie ryzyko indywidualne i wysokie ryzyko dla zdrowia publicznego | D |
Lokalny autoryzowany przedstawiciel ZEA
Producenci zagraniczni nieposiadający fizycznego biura powinni wyznaczyć Lokalnego Przedstawiciela (LR), który będzie działał w ich imieniu. Lokalny przedstawiciel powinien być licencjonowany przez Ministerstwo Zdrowia jako sklep medyczny lub biuro naukowe (w przypadku biura naukowego, import i dystrybucja powinny być wykonywane przez wyznaczony Licencjonowany Sklep Medyczny). Wnioskodawcy mogą wyznaczyć swojego dystrybutora jako Lokalnego Przedstawiciela. Jednakże posiadanie niezależnego Lokalnego Przedstawiciela, nieposiadającego interesów handlowych, zapewniłoby wymaganą elastyczność w zakresie wyznaczania wielu dystrybutorów w Zjednoczonych Emiratach Arabskich. Podczas rejestracji urządzenia należy podać dane zarówno LR, jak i dystrybutora.
Oficjalny proces klasyfikacji z MoHAP ZEA
MoHAP Zjednoczonych Emiratów Arabskich wprowadził oficjalną usługę klasyfikacji, szczególnie przydatną, gdy nie masz pewności, czy Twój produkt wymaga rejestracji. Usługa ta klasyfikuje produkty wszystkich typów i form na podstawie ich prezentacji, składu, zastosowania i projektu. Wymagania mogą się różnić w zależności od charakteru produktu, klasy ryzyka i statusu prawnego.
Klasyfikacja wskazuje, czy produkt musi być zarejestrowany w MOHAP. Jeśli rejestracja jest wymagana, produkt musi zostać zarejestrowany zgodnie z klasą określoną w liście klasyfikacyjnym. List ten jest ważny przez trzy lata od daty wydania.
Oficjalne wyniki klasyfikacji mogą być następujące:
- Nie wymaga rejestracji w MOHAP
- Zatwierdzony przez UAE MOHAP jako urządzenie medyczne, ograniczone do użytku profesjonalnego
- Zatwierdzony przez MOHAP ZEA jako wyrób medyczny dostępny bez recepty
Rejestracja urządzeń medycznych w Zjednoczonych Emiratach Arabskich
Niektóre urządzenia, które nie wymagają rejestracji produktu ani wcześniejszego umieszczenia w wykazie lub zatwierdzenia do importu. Takie produkty zwolnione z obowiązku rejestracji lub umieszczenia w wykazie muszą złożyć wniosek i uzyskać zezwolenie na przywóz w celu wprowadzenia do obrotu w Zjednoczonych Emiratach Arabskich.
W przypadku innych urządzeń, przywóz nie zostanie rozliczony, chyba że wstępne zatwierdzenie przywozu przesyłki zostanie wydane przez DRCD. Takie urządzenia muszą być wymienione lub zarejestrowane w celu importu do ZEA.
Wykaz urządzeń: Ogólnie rzecz biorąc, produkty używane w szpitalach pod profesjonalnym nadzorem i urządzenia klasy I nie podlegają szczegółowej ocenie i muszą być wymienione w wykazie. Certyfikat umieszczenia na liście zostanie wydany przez agencję. Urządzenia po umieszczeniu w wykazie muszą uzyskać pozwolenie na import w celu wprowadzenia do obrotu w Zjednoczonych Emiratach Arabskich.
Rejestracja urządzeń: Czynność Rejestracji obejmuje Rejestrację Witryny i Produktu.
- Rejestracja zakładu:Zakład produkcyjny musi zostać zarejestrowany, jeśli urządzenie wyprodukowane w tym zakładzie jest importowane do ZEA po raz pierwszy. W przypadku kolejnych urządzeń wyprodukowanych w tym samym zakładzie wystarczy jedynie rejestracja urządzenia, a rejestracja zakładu nie jest wymagana.
- Rejestracja urządzenia:Urządzenia te podlegają przeglądowi przez komitet techniczny, który po ich zatwierdzeniu wyda certyfikat licencyjny.
Przepływ procesu
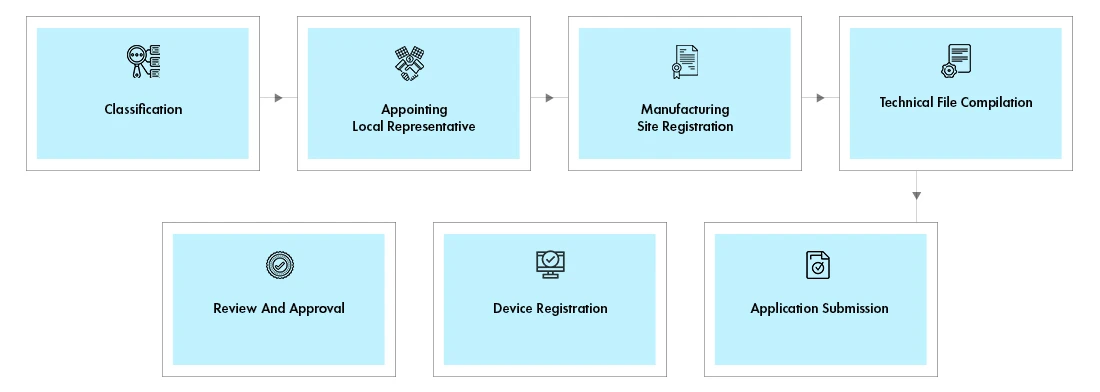
Zarządzanie cyklem życia urządzenia po zatwierdzeniu
- Zarządzanie zmianami po zatwierdzeniu - modyfikacje istniejących zatwierdzeń urządzeń medycznych, takie jak dodanie nowych wariantów, akcesoriów; dodanie nowych wskazań do stosowania, między innymi
- Utrzymanie zatwierdzeń i rejestracji poprzez terminowe uiszczanie opłat administracyjnych i rejestracyjnych.
- Odnowienie licencji
- Współpraca między MoH a producentem
- Zarządzanie importem
Dzięki wyłącznemu centrum dostaw w Dubaju, Freyr posiada autorytatywną pozycję na rynku urządzeń medycznych w Zjednoczonych Emiratach Arabskich i przedstawia klasyfikację urządzeń, a także dekoduje przepisy dotyczące wytycznych w celu zapewnienia lepszej zgodności. Wspieramy klientów w kompilacji dokumentów zgodnie ze standardami, a tym samym zapewniamy szybkie zatwierdzenia. Freyr oferuje pełen zakres usług regulacyjnych związanych z udanym marketingiem urządzeń.
Podsumowanie
| Typ urządzenia | Lista urządzeń | Rejestracja urządzenia | Licencja importowa |
|---|---|---|---|
Urządzenie zwolnione z zatwierdzenia przedimportowego (Zgodnie z wykazem w załączniku 3) | NA | NA | TAK |
| TAK | NA | TAK |
| Wszystkie inne urządzenia | NA | TAK | TAK |
Ekspertyza Freyr
- Wywiad regulacyjny
- Należyta staranność regulacyjna
- Formalna klasyfikacja urządzeń medycznych
- Rejestracja urządzenia
- Autoryzowane przedstawicielstwo ZEA
- Wsparcie w zakresie tłumaczeń
- Obsługa etykietowania
- Identyfikacja i kwalifikacja dystrybutorów
- Zarządzanie zmianami po zatwierdzeniu
- Odnowienie i przeniesienie licencji
- Odprawa celna

Nasza lokalizacja w Zjednoczonych Emiratach Arabskich
1001 Prism Tower,
Happiness Street, Business Bay,
117938, Dubaj, Zjednoczone Emiraty Arabskie
