wyroby medyczne Usługiwyroby medyczne
w Singapurze Przegląd
wyroby medyczne Singapurze podlegają regulacjom ustawy o produktach zdrowotnych (HPA) oraz rozporządzenia w sprawie produktów zdrowotnych (wyroby medyczne) z 2010 r.
Organ regulacyjny: Health Science AuthorityHSA)
Rozporządzenie: Przepisy dotyczące wyrobówwyroby medyczne z 2010 r.
Ścieżka regulacyjna: Oddział ds. wyrobów medycznych Urzędu ds. Nauk o ZdrowiuHSA)
Upoważniony przedstawiciel: Rejestrujący Singapur
Wymóg SZJ: SS 620:2016, Singapurska norma dotycząca dobrych praktyk dystrybucyjnych wyroby medyczne oraz ISO 13485:2016
Ocena danych technicznych: Health Science AuthorityHSA)
Ważność licencji: Wszystkie licencje dealerskie są ważne przez 12 miesięcy od daty zatwierdzenia.
Labelling : Wytyczne regulacyjne, GN-23 zmienione (1 marca 2020 r.)
Format zgłoszenia: Online
Język: Angielski
Klasyfikacja urządzeń medycznych HSA
HSA 16 zestawów zasad w celu klasyfikacji wyroby medyczne najniższego do najwyższego ryzyka do klas A, B, C i D.
Klasyfikacja ryzyka zależy od takich czynników, jak czas trwania kontaktu, stopień inwazyjności, zamierzone zastosowanie i metoda podawania.
Klasyfikacja urządzeń medycznych, HSA
| Klasa ryzyka | Poziom ryzyka | Przykłady urządzeń medycznych |
|---|---|---|
| Klasa A | Niskie ryzyko | Przeglądarka filmów, ręka chirurgiczna, osłona, maska tlenowa |
| Klasa B | Ryzyko niskie do umiarkowanego | Mankiet do pomiaru ciśnienia krwi, sterylizator trzpienia |
| Klasa C | Ryzyko od umiarkowanego do wysokiego | Monitor pacjenta, mezin rentgenowski |
| Klasa D | Wysokie ryzyko | Stenty serca, rozruszniki serca |
Klasyfikacja IVD
wyroby medyczne In-Vitro są sklasyfikowane poniżej od najniższego do najwyższego ryzyka.
Klasa ryzyka | Poziom ryzyka | Przykłady urządzeń medycznych in vitro |
|---|---|---|
| Klasa A | Niskie ryzyko indywidualne i niskie ryzyko dla zdrowia publicznego | Pojemnik na próbki |
| Klasa B | Umiarkowane ryzyko indywidualne lub niskie ryzyko dla zdrowia publicznego lub jedno i drugie | Witamina B12, autotest ciążowy, przeciwciała przeciwjądrowe, paski testowe do badania moczu |
| Klasa C | Wysokie ryzyko indywidualne lub umiarkowane ryzyko dla zdrowia publicznego lub jedno i drugie | Samokontrola stężenia glukozy we krwi, typowanie HLA, badania przesiewowe PSA , różyczka IgM |
| Klasa D | Wysokie ryzyko indywidualne i wysokie ryzyko dla zdrowia publicznego | Badania przesiewowe dawców krwi na obecność wirusa HIV, zestaw do diagnostyki HIV |
Autoryzowany przedstawiciel / rejestrujący w Singapurze ds. urządzeń medycznych
Rejestrujący jest łącznikiem między firmą a HSA who zajmuje się rejestracją urządzenia w Singapurze. Singapurski autoryzowany przedstawiciel ds. urządzeń medycznych przetwarza wniosek rejestracyjny w HSA i jest właścicielem rejestracji urządzenia w HSA . Tylko spółki lub podmioty z siedzibą w Singapurze mogą działać jako Rejestrujący; muszą one być również zarejestrowane w HSA.
Rejestracja urządzeń medycznych HSA
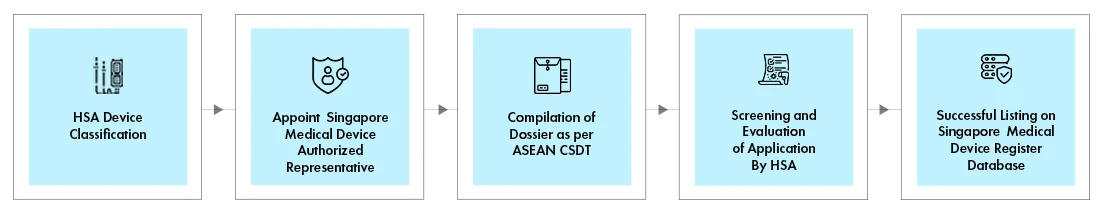
Proces rejestracji urządzeń medycznych w HSA odbywa się za pośrednictwem internetowego systemu informacji i komunikacji o urządzeniach medycznych HSA (MEDICS). Każda rejestracja urządzenia HSA odbywa się za pośrednictwem określonej ścieżki oceny, w zależności od następujących elementów:
- Klasyfikacja ryzyka urządzenia.
- Liczba uprzednich zatwierdzeń wydanych przez zagraniczne referencyjne agencje regulacyjne.
- Czas trwania historii bezpieczeństwa marketingowego urządzenia.
Trasa oceny urządzenia określi czas realizacji (TAT), opłaty i dokumenty wymagane do rejestracji.
Rejestracja klasy A – wyroby medyczne klasy A wyroby medyczne zwolnione z rejestracji produktu. Jednakże podczas składania wniosku o licencję dystrybutora należy wypełnić listę zwolnień klasy A w systemie MEDICS.
Przepływ procesu
Zarządzanie cyklem życia urządzenia po zatwierdzeniu
Freyr zagranicznych producentów w end-to-end zarządzaniu cyklem życia urządzeń end-to-end , w tym w działaniach po uzyskaniu zatwierdzenia, takich jak:
- Zarządzanie zmianami po zatwierdzeniu - modyfikacje istniejących zatwierdzeń urządzeń medycznych, takie jak dodanie nowych wariantów i akcesoriów; dodanie nowych wskazań do stosowania, między innymi.
- Utrzymanie zatwierdzeń i rejestracji urządzeń medycznych poprzez terminowe uiszczanie opłat administracyjnych i rejestracyjnych.
- Odnowienie licencji.
Dzięki profesjonalnemu zespołowi zapewniającemu wsparcie regulacyjne, Freyr wspiera producentów w utrzymaniu jakości i bezpieczeństwa wymaganych do zatwierdzenia. Eksperci Freyruważnie obserwują aktualizacje przepisów i informują klientów o krokach, które należy podjąć w celu zapewnienia zgodności produktu z obowiązującymi normami.
Podsumowanie
Czas przetwarzania rejestracji produktu podano w poniższej tabeli.
| Klasa ryzyka | Natychmiast | Przyspieszony | Skrócony | Pełna ocena | Pełny (program przeglądu priorytetów) |
|---|---|---|---|---|---|
| Klasa B | Natychmiastowa rejestracja po przesłaniu zgłoszenia | 100 dni roboczych | 160 dni roboczych | 120 dni roboczych | |
| Klasa C | Natychmiastowa rejestracja po przesłaniu (tylko dla samodzielnej medycznej aplikacji mobilnej klasy C) | 120 dni roboczych | 160 dni roboczych | 220 dni roboczych | 165 dni roboczych |
| Klasa D | 180 dni roboczych | 220 dni roboczych | 310 dni roboczych | 235 dni roboczych | |
| Klasa D (urządzenia zawierające Produkty lecznicze) | 220 dni roboczych | 310 dni roboczych |
Czas oczekiwania na zmianę rejestrującego wynosi 40 dni roboczych.
UWAGA-
- wyroby medyczne klasy A wyroby medyczne zwolnione z rejestracji produktu.
- Czas realizacji nie obejmuje czasu potrzebnego na udzielenie odpowiedzi na wszelkie prośby o wyjaśnienia lub dodatkowe informacje ze strony HSA na etapie oceny.
Ekspertyza Freyr
- Należyta staranność regulacyjna przy rejestracji urządzeń w HSA, Singapur
- Klasyfikacja i grupowanie urządzeń medycznych HSA
- Wsparcie dla oceny organu oceny zgodności (CAB)
- ASEAN Common Submission Dossier Template (CSDT) Kompilacja dokumentacji
- Rejestracja urządzenia HSA ;
- Reprezentacja prawna
- Wsparcie etykietowania
- Identyfikacja i kwalifikacja dystrybutorów
- Nadzór po wprowadzeniu do obrotu
- Zarządzanie zmianami po zatwierdzeniu
- Odnowienie i przeniesienie licencji
- Usługi składania wniosków i współpracy z HSA