Przegląd rejestracji Software as a Medical Device SaMD)
Oprogramowanie jako wyrób medyczny (SaMD), zwane również oprogramowaniem wyrobów medycznych (MDSW), jest najnowszym, szybko zyskującym na popularności tematem w segmencie opieki zdrowotnej. Globalny SaMD szacuje sięna US ,5 mld US do 2027 r., przy średnim rocznym tempie wzrostu (CAGR) na poziomie 21,9% w latach 2020–2027. Wzrost ten jest spowodowany różnymi czynnikami związanymi z SaMD , takimi jak wdrożenie Internetu rzeczy (IoT), cyfrowe platformy opieki zdrowotnej oraz wdrożenie oprogramowania do ciągłego monitorowania parametrów fizjologicznych przez pracowników służby zdrowia w celu zapewnienia zdalnej pomocy. Proces ten został dodatkowo przyspieszony przez pandemię COVID, która spowodowała konieczność świadczenia usług opieki zdrowotnej na odległość, a tym samym stworzyła potrzebę usprawnienia procesu rejestracji oprogramowania jako wyrobu medycznego (SaMD). Istnieją trzy rodzaje oprogramowania związane z wyroby medyczne o klasyfikację oprogramowania jako wyrobu medycznego (SaMD), takie jak:
- Oprogramowanie w urządzeniu medycznym (SiMD)
- Oprogramowanie jako wyroby medyczne SaMD)
- Oprogramowanie używane do produkcji/konserwacji urządzenia medycznego
Globalny scenariusz regulacyjny
W odniesieniu do SaMD, różne typy są wykorzystywane do różnych zastosowań, takich jak badania przesiewowe i diagnostyka, monitorowanie i ostrzeganie, zarządzanie chorobami itp. Agencje zdrowia w krajach rozwiniętych lub ściśle regulowanych, takich jak UE, US, Kanada i Australia, określiły przepisy dotyczące SaMD, a niektóre z nich opracowały już wytyczne, podczas gdy inne są w trakcie tego procesu. Niektóre rynki częściowo regulowane i nieuregulowane traktują takie oprogramowanie jako wyroby medyczne nie mają zróżnicowanych i szczegółowych wytycznych dotyczących klasyfikacji oprogramowania jako wyrobu medycznego (SaMD). Stosują one międzynarodowe, zharmonizowane wytyczne dotyczące oceny i zatwierdzania oprogramowania. Poniżej wymieniono niektóre z najważniejszych wytycznych dotyczących SaMD:
- Wytyczne IMDRF dotyczące klasyfikacji, QMS, oceny cyberbezpieczeństwa, oceny klinicznej
- EU MDR zawiera szczegółowe informacje na temat tej kategorii urządzeń
- Wytyczne MDCG dotyczące kwalifikacji i klasyfikacji SaMD, wymagania CER / PER dla SaMD
- FDA US FDA dotyczące cyberbezpieczeństwa, oceny klinicznej i wymogów rejestracyjnych dla różnych rodzajów oprogramowania, takich jak systemy decyzyjne, PACS, aplikacje mobilne itp.
- Wytyczne Health Canada dotyczące definicji i klasyfikacji
- Nowe przepisy TGA dotyczące wyroby medyczne opartych na oprogramowaniu, które wejdą w życie w sierpniu 2020 r.
Rejestracja SaMD na innych światowych rynkach jest rozpatrywana indywidualnie i wymaga ścisłej współpracy z odpowiednią agencją zdrowia w celu uzyskania zgody. Ogólna ścieżka rejestracji SaMD obejmuje:
- Ustalenie, czy dane oprogramowanie kwalifikuje się jako SaMD
- Klasyfikacja urządzeń na podstawie związanego z nimi ryzyka
- Określenie obowiązujących norm i wymogów dotyczących danych przez daną agencję ds. zdrowia
- Generowanie danych wymaganych przez odpowiednią agencję
- Kompilacja dokumentacji technicznej zgodnie z wymaganiami krajowymi
- Składanie i rozwiązywanie zapytań do momentu zatwierdzenia
- Zarządzanie cyklem życia po zatwierdzeniu
End-to-End wsparcie End-to-End firmy Freyr dla SaMD
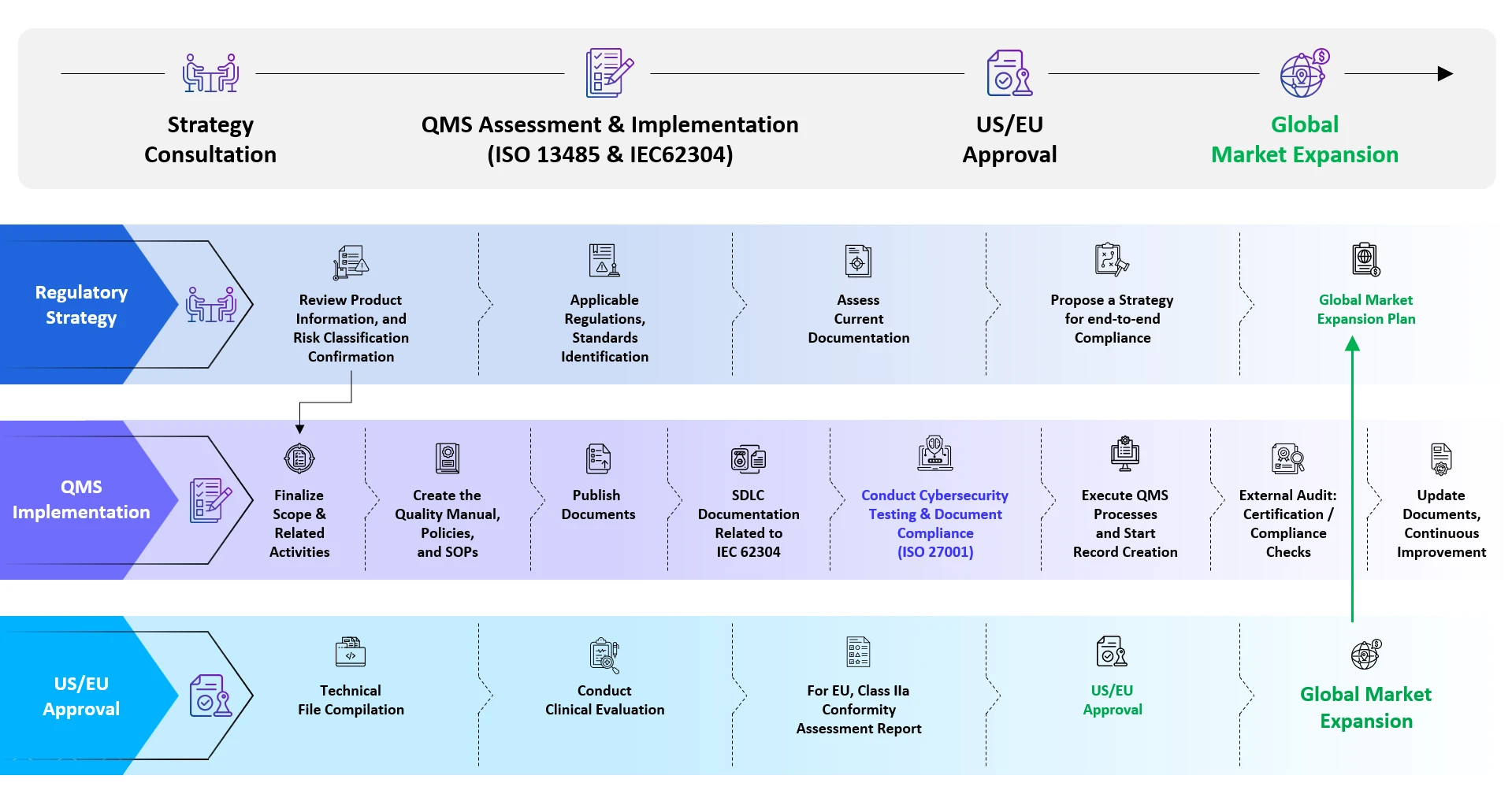
Usługi rejestracji Software as a Medical Device SaMD)
Rejestracja Software as a Medical Device SaMD) - wiedza specjalistyczna
- Regulatory Intelligence Services
- Należyta staranność regulacyjna / raporty strategiczne
- Kwalifikacja i klasyfikacja SaMD
- Identyfikacja obowiązujących norm
- Analiza luk w dokumentach źródłowych
- Rejestracja SaMD
- Zgodność z Quality Management System (QMS)
- Usługi konsultacyjne w zakresie oceny cyberbezpieczeństwa
- Usługi konsultacyjne w zakresie badań oceny klinicznej
- Kompilacja raportów oceny klinicznej (CER) / raportów oceny produktu (PER) itp.
- Zarządzanie zmianami po zatwierdzeniu





